چرا عناصر را در یک جدول مرتب کنیم؟
دیدن عناصر شیمیایی چیده شده در جدول تناوبی مدرن به اندازه دیدن نقشه جهان آشناست، اما همیشه چندان واضح نبوده است.
جدول تناوبی عناصر شیمیایی که اغلب جدول تناوبی نامیده می شود، همه عناصر شیمیایی کشف شده را در ردیف ها (که دوره نامیده می شوند) و ستون ها (به نام گروه ها) با توجه به افزایش عدد اتمی سازماندهی می کند. دانشمندان از جدول تناوبی برای اشاره سریع به اطلاعات مربوط به عنصری با جرم اتمی و نماد شیمیایی خاصی استفاده می کنند. چینش جدول تناوبی همچنین به دانشمندان اجازه می دهد تا روندها در خواص عنصر، از جمله الکترونگاتیوی،خصلت فلزی و نافلزی و شعاع اتمی را تشخیص دهند.
بسیاری از دانشمندان روی مشکل سازماندهی عناصر کار کردند، اما دیمیتری مندلیف اولین نسخه خود از جدول تناوبی را در سال 1869 منتشر کرد و اغلب به عنوان مخترع آن شناخته می شود. از آن زمان، جدول تناوبی تکامل یافته است تا بیش از 150 سال پیشرفت علمی و درک در شیمی و فیزیک را منعکس کند. امروزه با داشتن 118 عنصر شناخته شده، به طور گسترده به عنوان یکی از مهمترین دستاوردهای علم در نظر گرفته می شود.
خالق جدول تناوبی، دیمیتری مندلیف، در سال 1869 شروع به جمعآوری و مرتبسازی ویژگیهای شناخته شده عناصر کرد.
آیا جدول تناوبی مدرن تغییر می کند؟ اگر بله، چگونه و چه کسی این کار را انجام می دهد؟
جدول تناوبی که امروزه می شناسیم توسط اتحادیه بین المللی شیمی محض و کاربردی یا IUPAC (eye-you-pack) مدیریت می شود. در حالی که بسیاری از آنچه در جدول تناوبی است ثابت بوده و بعید است تغییر کند، سازمان IUPAC مسئول تصمیم گیری در مورد آنچه باید تغییر کند. آنها معیارهایی برای کشف عنصر جدید ایجاد کرده اند.
علاوه بر این، به هر عنصر جدید باید یک نام و نماد موقت اختصاص داده شود و در صورت تایید، یک نام رسمی داده شود.
نحوه کار با شبیه ساز
صفحه کاوش شبیه ساز:
در سمت راست عناصر گروه 16 را مشاهده می کنید و در پایین صفحه یک دوره را می بینید، با انتخاب یک اتم از گروه 11 دوره آن در پایین صفحه نمایش داده می شود که امکان نمایش تمام عناصر را به شما می دهد. با انتخاب یک عنصر شما ساختار آن را در وسط صفحه مشاهده خواهید کرد که در پایین مدل اتم انتخابی تعداد الکترون، پروتون و نوترون آن اتم دیده خواهد شد.
در سمت چپ شبیه ساز می توان سه ویژگی مهم اتم را بررسی کرد که به ترتیب شامل موارد زیر است:
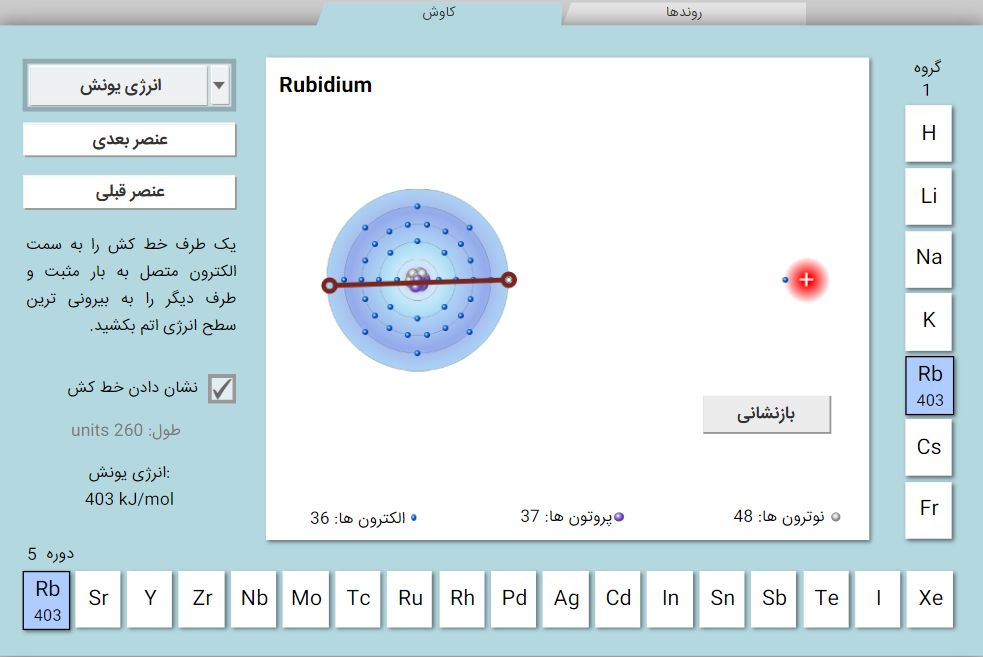
1- شعاع اتمی: به راحتی با شبیه ساز قابل اندازه گیری است، برای این کار خط کش را انتخاب کنید و هسته را به آخرین الکترون وصل کنید.
2- انرژی یونش(انرژی مورد نیاز برای حذف یک الکترون از یک اتم یا یون در حالت گازی را انرژی یونش می نامند): برای اندازه گیری انرژی، یون اتم را به هسته اتم سمت راست که با بار مثبت نشان داده شده است نزدیک کنید تا یک الکترون از دست دهد، پس از انجام این فرآیند انرژی یونش نشان داده خواهد شد.
3- الکترون خواهی(میزان انرژی آزاد شده در زمان اضافه شدن یک الکترون به اتم یا مولکول در حالت خنثی و ایجاد یون منفی می گویند): برای این کار اتم را به سمت را بکشید تا الکترون اتم سمت راس را جذب کند که در نهایت انرژی الکترون خواهی به دست خواهد آمد.
صفحه روندهای شبیه ساز:
در این صفحه جدول تناوبی را مشاهده می کنید که با رنگ های مختلف نشان داده شده است و در سمت چپ مفهوم هر رنگ نوشته شده است. با انتخاب هر رنگ توضیح هر مفهوم را مشاهده خواهید کرد.
با انتخاب و کلیک بر روی هر اتم اطلاعات آن در بالا قابل مشاهده است.
در پایین جدول از قسمت ویژگی ها می توان: شعاع اتمی، انرژی یونش و الکترون خواهی را مشاهده کرد.
- اگر شعاع اتمی را انتخاب کنید جدول تناوبی بر این اساس نمایش داده خواهد شد، می توان با انتخاب هر اتم شعاع اتمی آن را ببینید و اگر دقت کنید در پایین جدول تناوبی قسمت نمودار قرار دارد که با انتخاب آن روند تغییر شعاع اتمی در گروه ها و دوره ها را مشاهده خواهید کرد.
- اگر انرژی یونش انتخاب شود می توان با انتخاب هر اتم انرژی یونش را مشاهده کرد و با انتخاب نمودار، میزان انرژی یونش اتم ها در گروه ها و دوره ها مشاهده خواهد شد.
- با انتخاب الکترون خواهی می توان میزان الکترون خواهی هر اتم را مشاهده کرد و با انتخاب نمودار، میزان الکترون خواهی اتم ها در گروه ها و دوره ها مشاهده خواهد شد.
اگر با مفاهیم جدید روبرو شدید به شبیه سازهای قبلی مراجعه نمایید:
شبیه ساز بازی با عناصر جدول تناوبی
گروه 1: فلزات قلیایی
فلزات قلیایی عناصر شیمیایی موجود در گروه 1 جدول تناوبی هستند. فلزات قلیایی عبارتند از: لیتیوم، سدیم، پتاسیم، روبیدیم، سزیم و فرانسیم. اگرچه هیدروژن به دلیل پیکربندی الکترونی خود اغلب در گروه 1 فهرست می شود، اما از نظر فنی یک فلز قلیایی نیست زیرا به ندرت رفتار مشابهی از خود نشان می دهد. کلمه قلیایی نام خود را از کلمه عربی "القالی" به معنای "از خاکستر" گرفته است.
این عناصر با آب واکنش داده و یون های هیدروکسید تشکیل می دهند و محلول های قلیایی ایجاد می کنند(PH> 7).
فلزات قلیایی از واکنش پذیرترین فلزات هستند. این فلزات با بافت نرم و رنگ نقره ای خود مشخص می شوند. آنها همچنین نقطه جوش و ذوب پایینی دارند و نسبت به اکثر عناصر چگالی کمتری دارند. همه این ویژگی ها را می توان به شعاع اتمی بزرگ و پیوند فلزی ضعیف این عناصر نسبت داد. این عناصر یک الکترون در لایه ظرفیت خود دارند.
گروه 2: فلزات قلیایی خاکی
فلزات قلیایی خاکی گروه 2 شامل بریلیم، منیزیم، کلسیم، باریم، استرانسیم و رادیوم هستند و فلزات نرم و نقره ای هستند که نسبت به فلزات قلیایی گروه 1 خاصیت فلزی کمتری دارند. اگرچه بسیاری از ویژگیها در سرتاسر گروه مشترک هستند، فلزات سنگینتر مانند Ca ،Sr ،Ba و Ra تقریباً به اندازه فلزات قلیایی گروه 1 واکنشپذیر هستند. همه عناصر گروه 2 دارای دو الکترون در لایه ظرفیت خود می باشند.
گروه 3:
روند مشاهده شده در خواص عناصر گروه 3 شبیه به گروه های 1 و 2 است. تعداد الکترون های ظرفیتی این گروه 3 به صورت ns2(n-1)d1 است.
گروه 4:
از آنجایی که عناصر گروه 4 میل ترکیبی بالایی با اکسیژن دارند، هر سه فلز به طور طبیعی به عنوان سنگ معدنی اکسیدی هستند. آرایش الکترون های ظرفیت لایه آخر به صورت ns2(n-1)d2 است. یعنی این گروه در لایه ظرفیت خود 4 الکترون دارند.
گروه 5:
همه فلزات گروه 5 به طور معمول در طبیعت به عنوان سنگ معدنی اکسیدی یافت می شوند. Nb و Ta به قدری مشابه است که این عناصر معمولا در سنگهای مشابه یافت میشوند. دوبنیوم (Db) بسیار رادیواکتیو است. پایدارترین ایزوتوپ شناخته شده، دوبنیوم-268، نیمه عمر کمی بالاتر از یک روز دارد. دوبنیوم به طور طبیعی در زمین وجود ندارد و به صورت مصنوعی تولید می شود.
گروه 6:
گروه ششم جدول تناوبی شامل فلزات واسطه کروم (Cr)، مولیبدن (Mo)، تنگستن (W) و سیبورگیوم (Sg)است. اوربیتال s و d لایه ظرفیت این عناصر نیمهپر است
گروه 7:
عناصر گروه 7 دارای هفت الکترون ظرفیت هستند.
گروه 7 شامل فلزات واسطه منگنز (Mn)، تکنسیوم (Tc)، رنیوم (Re)، و بوهریم (Bh) است.
گروه 8:
شیمی گروه 8 تحت سلطه آهن است که فراوانی بالای آن در پوسته زمین به دلیل پایداری بسیار بالای هسته آن است. از سوی دیگر، روتنیوم و اوسمیم عناصر بسیار کمیاب هستند. به دلیل نقطه ذوب بالای آهن (1538 درجه سانتی گراد)، انسان های اولیه نمی توانستند از آن برای ابزار یا سلاح استفاده کنند. تکنیک های پیشرفته مورد نیاز برای کار با آهن اولین بار توسط تمدن هیتی ها در آسیای صغیر از 2000 سال قبل از میلاد ابداع شد، و آنها به عنوان یک راز کاملا محافظت شده باقی ماندند که به هیتی ها برای تقریبا یک هزار سال برتری نظامی داد. با فروپاشی تمدن هیتی ها در حدود 1200 قبل از میلاد، این فناوری به طور گسترده ای توزیع شده و به کشف عنصر آهن منجر شد.
گروه 9:
کبالت یکی از کمیاب ترین فلزات واسطه ردیف اول است. با این حال، سنگهای اکسیدی آن هزاران سال است که در شیشه و سفال برای تولید رنگ درخشانی که به نام «آبی کبالت» شناخته میشود و ترکیبات آن به مقدار زیادی در صنایع رنگ و سرامیک مصرف میشود. عناصر سنگینتر گروه 9 نیز نادر هستند. آنها به طور کلی در ترکیب با عناصر سنگینتر گروههای 8 و 10 در کانیهای Ni-Cu-S یافت میشوند.
گروه 10:
فلزات گروه 10 به رنگ سفید تا خاکستری روشن و دارای درخشندگی بالا، مقاومت در برابر کدر شدن، انعطاف پذیری بالایی دارند. عناصر این گروه شامل فلزات واسطه نیکل (Ni)، پالادیوم (Pd)، پلاتین (Pt) و دورمشتادیوم (Ds) است.
گروه 11:
«فلزات سکهای»، مس، نقره و طلا، در طول تاریخ چه از نظر نمادین و چه از نظر عملی اهمیت زیادی در جوامع داشتهاند. برای قرن ها، نقره و طلا توسط خانواده سلطنتی پوشیده شده است تا ثروت و قدرت خود را به نمایش بگذارند. گاهی اوقات از این فلزات در هنر نیز استفاده می شد. این عناصر نسبتاً غیر فعال هستند و واکنش پذیری از مس به طلا کاهش می یابد.
گروه 12:
عناصر گروه 12 تا حدی زیر پوسته های(n-1)dرا پر کرده اند، و از این رو، به طور دقیق، فلزات واسطه نیستند. فلزات گروه 12 از نظر فراوانی مشابه فلزات گروه 11 هستند و تقریباً همیشه در ترکیب با گوگرد یافت می شوند. فلزات گروه 12 دارای نقطه ذوب و جوش پایین هستند.
گروه 13:
خانواده بور شامل عناصر گروه 13 جدول تناوبی است، بور نیمه فلزی (B) و فلزات آلومینیوم (Al)، گالیم (Ga)، ایندیم (In) و تالیم (Tl) در این گروه قرار دارند. آلومینیوم، گالیم، ایندیم و تالیم دارای سه الکترون در بیرونی ترین لایه خود (یک اوربیتال s کامل و یک الکترون در اوربیتال p) با آرایش الکترون ظرفیتی ns2np1 هستند.
گروه 14:
همه عناصر گروه 14 (کربن، سیلیکون، ژرمانیوم، قلع و سرب) دارای آرایش الکترونی ns2np2 در لایه بیرونی خود هستند. کربن یکی از رایج ترین عناصر روی زمین است و زندگی روزمره را به شدت تحت تاثیر قرار می دهد. مولکول های رایج حاوی کربن عبارتند از دی اکسید کربن (CO2) و متان (CH4).
بسیاری از دانشمندان در زمینه های مختلف کربن را مطالعه می کنند: زیست شناسانی که در حال بررسی منشاء حیاتند. اقیانوس شناسانی که میزان اسیدی شدن اقیانوس ها را اندازه گیری می کنند و مهندسانی که ابزارهای فیلم الماس را توسعه می دهند.
گروه 15:
خانواده نیتروژن شامل ترکیبات زیر است: نیتروژن (N)، فسفر (P)، آرسنیک (As)، آنتیموان (Sb) و بیسموت (Bi). همه عناصر گروه 15 دارای آرایش الکترونی ns2np3 در لایه بیرونی خود هستند.
گروه 16:
خانواده اکسیژن که از عناصر اکسیژن، گوگرد، سلنیوم، تلوریم و پلونیوم تشکیل شده است. این عناصر را می توان در طبیعت در هر دو حالت آزاد و ترکیبی یافت. عناصر گروه 16 ارتباط نزدیکی با زندگی دارند.
گروه 17:
هالوژن ها در سمت چپ گازهای نجیب جدول تناوبی قرار دارند. پنج عنصر سمی و غیرفلزی گروه 17 جدول تناوبی را تشکیل می دهند و شامل: فلوئور (F)، کلر (Cl)، برم (Br)، ید (I) و استاتین (At) هستند. اگرچه استاتین رادیواکتیو است و فقط ایزوتوپ های کوتاه مدت دارد، اما رفتاری مشابه ید دارد و اغلب در گروه هالوژن قرار می گیرد. از آنجایی که عناصر هالوژن دارای هفت الکترون ظرفیتی هستند، تنها به یک الکترون اضافی نیاز دارند تا پایدار شود. این ویژگی آنها را نسبت به سایر گروه های غیرفلزی واکنش پذیرتر می کند. افزایش منظم بسیاری از خواص هالوژن ها در گروه 17 از فلوئور به ید وجود دارد. این شامل نقاط ذوب، نقاط جوش، شدت رنگ، شعاع یون هالید مربوطه، و چگالی عنصر است.
گروه 18:
گازهای نجیب (گروه 18) در انتهای سمت راست جدول تناوبی قرار دارند و قبلاً به آنها "گازهای بی اثر" گفته میشد، زیرا لایه ظرفیت آنها پر شده در نتیجه آنها را بسیار واکنش ناپذیر می کند. همگی در دمای اتاق به شکل گاز و تک اتمی وجود دارند. این عناصر به ترتیب از بالا به پایین جدول عبارتند از: هلیم (He)، نئون (Ne)، آرگون (Ar)، کریپتون (Kr)، زنون (Xe)، رادون (Rd) و عنصر تازه کشف شده اگانسون(Og). آرایش الکترونی لایه ظرفیت آن ها به جز هلیم ns2 np6 می باشد.
لانتانیدها:
لانتانیدها از عناصر بلوک f دوره شش در جدول تناوبی تشکیل شده است. در حالی که این فلزات را می توان فلزات واسطه در نظر گرفت، اما دارای ویژگی هایی هستند که آنها را از بقیه عناصر متمایز می کند.
آکتنیدها:
سری آکتنیدها شامل عناصری با اعداد اتمی 89 تا 103 است و دوره ششم و گروه سوم جدول تناوبی است. این سری ردیف زیر سری لانتانید است که در زیر بدنه اصلی جدول تناوبی قرار دارد. هر دو سری لانتانید و اکتینید به عنوان فلزات خاکی کمیاب شناخته می شوند. تمام اکتینیدها رادیواکتیو هستند. معروف ترین اکتینید اورانیوم است.
فعالیت: اگر با جدول به خوبی آشنا شدید به سوالات زیر پاسخ دهید.
1- آرایش الکترونی لایه ظرفیت گروه 2 و 12 را بنویسید.
2- عناصر گروه 17 برای رسیدن به آرایش گاز نجیب با کدام عناصر میل ترکیبی بیشتری دارند؟
3- چند عنصر رادیوکتیو جدول تناوبی را نام ببرید.
4- اگر یک عصنر جدید کشف شود چگونه دوره و گروه آن را مشخص خواهند کرد؟
- آشنایی با جدول تناوبی
- تشخیص گروه و دوره
- آشنایی با عدد و جرم اتمی
- مقایسه خواص فلزها و نافلزها
- بررسی خواص عناصر یک گروه یا یک دوره



سید عباس طاهری
۲۴ آبان ۱۴۰۴علی کرمی
شبیهسازها قابلیت دانلود ندارند، میتوانید به صورت تحت وب از تمامی آنها استفاده کنید.
(تمامی شبیهسازها در سایت قرار داشته و نیاز به دانلود اپلیکیشنهای مختلف ندارید.)