همانطور که می دانیدجدول تناوبی، تمامی عنصرهای کشف شده را شامل میشود. این جدول در هفت دوره تناوب افقی، با ترتیبِ عدد اتمی، چیده شده است و لانتانیدها و اکتیندها به صورت جداگانه در زیر تناوبها آورده شدهاند.
در تناوب اول، هیدروژن و هلیوم قرار دارند. سپس دو دوره تناوب با هشت عنصر در آن وجود دارند. این تناوبها به ترتیب شامل عناصری از لیتیوم تا نئون برای تناوب دوم و از سدیم تا آرگون برای تناوب سوم است. پس از این دو تناوب، دو دوره دیگر با 18 عنصر قرار دارند. تناوب چهارم از پتاسیم تا کریپتون و تناوب پنجم از روبیدیوم تا زنون است. اولین تناوب بلند با تعداد 32 عنصر از سزیم تا رادون با حذف لانتانیدها نمایش داده میشود. لانتانیدها به صورت جداگانه در پایین جدول نمایش داده میشوند. این کار سبب میشود تا 18 عنصر دیگر با خواص مشابه در کنار یکدیگر قرار بگیرند. دومین تناوب بلند شامل فرانسیم تا اوگانسون است. به طور مشابه از این گروه هم اکتینیدها حذف شده است.
طبقهبندی عناصر در گروهها
جدول تناوبی شامل ۱۸ بلوک یا گروه می باشد. بهتر است عنصرها را به صورت افقی و عمودی دستهبندی کنیم. (به صورت افقی با نام تناوب و عمودی به صورت گروه دستهبندی میکنیم.) در گروه اول، فلزات قلیایی از لیتیوم تا فرانسیم وجود دارند. در گروه دوم، فلزات قلیایی خاکی از برلیم تا رادیم وجود دارند. به همین ترتیب گروه 13 گروه بور، گروه 14 کربن، گروه 15 نیتروژن، گروه 16 اکسیژن و گروه 17 هالوژن نامگذاری میشوند. شش گاز نجیب شامل هلیوم، نئون، آرگون، کریپتون، زنون و رادون که در انتهای هر دوره تناوب قرار دارند و گروه 18 جدول تناوبی را تشکیل میدهند
توجه: هیدروژن در گروه 1 قرار دارد اما خواص آن شبیه فلزات قلیایی یا هالوژنها نیست. گروه ۳ تا ۱۲ با نام فلزات واسطه نامگذاری میشوند. به عنوان مثال از اسکاندیم تا روی را میتوان در نظر گرفت.
دستههای جدول تناوبی چیست؟
جدول تناوبی را میتوان به بلوکها (دستهها) مختلف تقسیم کرد. هر بلوک را میتوان بر اساس آخرین زیر لایه در حال پرشدن، نامگذاری کرد. دسته s شامل دو گروه اول ودوم به همراه هیدروژن و هلیوم است. گروههای 13 تا 18 (شامل شبه فلزات) را دسته p نامگذاری میکنیم. دسته d شامل گروههای 3 تا 12 (فلزات واسطه) است. گروه f نیز شامل لانتانیدها و اکتینیدها است.
روندهای تناوبی در جدول تناوبی
روندهای تناوبی، الگوهای ویژهای در جدول تناوبی هستند که به کمک آنها میتوان جنبههای مختلفی از یک عنصر همچون اندازه و خواص الکترونی را مورد بررسی قرار داد. اصلیترین روندهای تناوبی عبارتند از خواص فلزی و نافلزی، شعاع اتمی، نقطه ذوب. در حقیقت، بررسی روندهای تناوبی ابزاری را در اختیار یک شیمیدان قرار میدهد تا از طریق آن، پیشبینی خواص عناصر، با سرعت بیشتری انجام شود. روندهای تناوبی به این دلیل وجود دارند که ساختارهای اتمی مشابهی در عناصر با گروهها و تناوبهای یکسان دیده میشود که حاصل طبیعت تناوبی عناصر است.
روند شعاع اتمی
شعاع اتمی، نیمی از فاصله تعادلی بین هسته دو اتم یکسان که با هم پیوند کوالانسی داده اند ذکر میشود. البته این تعریف قدری پیچیده است چراکه همه اتمها به یک شکل با یکدیگر پیوند تشکیل نمیدهند و پیوندهای کووالانسی، یونی و فلزی گواه این ادعا هستند. گرچه این احتمال وجود دارد که بیشتر اتمها، پیوندهایی کووالانسی با یکدیگر تشکیل دهند. شعاع کووالانسی این مولکولها را به طور معمول به عنوان شعاع اتمی در نظر میگیرند. این فاصله را با واحد پیکومتر اندازهگیری میکنند. شعاع همه اتم ها با روش گفته شده قابل اندازه گیری نیست. شعاع دسته دیگری از اتمها نیمی از فاصله بین هسته دو اتم یکسان در حالی که مماس هم قرار دارند محاسبه می شود و به شعاع واندروالسی معروف است.
در هر تناوب از چپ به راست، شعاع اتمی کاهش پیدا میکند زیرا در هر تناوب، تمامی الکترونها به یک لایه اضافه میشوند. به طور همزمان نیز به هسته، پروتون اضافه خواهد شد. در نتیجه ی این اتفاق، اثر جاذبه هسته افزایش پیدا میکند. این امر به این معنی است که هسته با شدت بیشتری الکترونها را به سمت خود جذب میکند و در نهایت، لایههای الکترونی به هسته نزدیکتر میشوند. با نزدیکی لایههای الکترونی به هسته، الکترونهای لایه ظرفیت نیز به هسته نزدیک خواهند شد و شعاع اتمی کاهش پیدا میکند.
در هر گروه از بالا به پایین، شعاع اتمی افزایش مییابد. با توجه به افزایش عدد کوانتومی، الکترونهای ظرفیت، سطوح بالاتری را اختیار میکنند. در نتیجه، با افزایش عدد n، فاصله الکترونها از هسته بیشتر خواهد شد. اثر پوششی مانع از جذب این الکترونها به هسته خواهد شد که این امر سبب میشود تا با قدرت کمتری الکترونها در کنار هسته قرار بگیرند و حاصل این کار، افزایش شعاع اتمی خواهد بود. خلاصه روندهای تناوبی در خصوص شعاع اتمی، در زیر آورده شده است:
- در هر تناوب از چپ به راست، شعاع اتمی کاهش پیدا میکند.
- در هر گروه از بالا به پایین، شعاع اتمی افزایش مییابد.
روند نقطه ذوب
همانطور که می دانید زمانی که یک جامد را حرارت میدهیم، ذرات تشکیلدهنده آن شروع به ارتعاش میکنند. در اثر این ارتعاش، ماده مورد نظر انرژی جنبشی جذب میکند. در نهایت، آرایش منظم ذرات جامد از بین میرود و جامد شروع به ذوب شدن خواهد کرد. نقطه ذوب دمایی است که در آن، یک جامد شروع به ذوب شدن میکند و از فاز جامد به مایع تبدیل می شود.
به طور کلی، هرقدر پیوندهای بین اتمهای یک عنصر قویتر باشند، انرژی بیشتری برای شکستن پیوندها مورد نیاز است. با توجه به اینکه دما به طور مستقیم با انرژی در ارتباط است، هرقدر انرژی تفکیک پیوند بالاتر باشد، دمای متناظر با آن نیز بیشتر خواهد بود.
لازم به ذکر است که نقطه ذوب از یک روند مشخصی پیروی نمیکند اما نتایج مشخصی را میتوان به کمک قانون زیر برای آن بیان کرد:
- فلزات به طور کلی نقطه ذوب بالایی دارند.
- بیشتر نافلزات، دارای نقطه ذوب پایینی هستند.
- نافلز کربن(آلوتروپ الماس)، بالاترین نقطه ذوب را در میان تمامی عناصر دارد. همچنین، شبه فلز بور را نیز باید در میان عناصر با نقطه ذوب بالا قرار داد.
روند خاصیت فلزی
خاصیت فلزی یک عنصر را میتوان با سختیِ از دست دادن یک الکترون در اتم مرتبط کرد. در هر تناوب از چپ به راست خاصیت فلزی کاهش پیدا میکند زیرا جاذبه بین الکترونهای ظرفیت و هسته افزایش مییابند و به این ترتیب، اتم، دشوارتر الکترون از دست میدهد. در هر گروه از بالا به پایین هم به دلیل افزایش شعاع اتم، خاصیت فلزی افزایش پیدا میکند. زمانی که اندازه اتم افزایش پیدا کند، فاصله لایه خارجی از هسته، بیشتر میشود. در این شرایط، عدد کوانتومی اصلی n افزایش مییابد و تمرکز چگالی متوسط الکترونی از روی هسته برداشته خواهد شد. در نتیجه، الکترونهای لایه ظرفیت، جاذبه کمتری را نسبت به هسته احساس میکنند و اتمها خیلی سادهتر الکترون از دست میدهند که همین امر موجب افزایش خاصیت فلزی خواهد شد. خلاصه روندهای تناوبی در زیر آورده شده است:
- در هر تناوب از چپ به راست، خاصیت فلزی کاهش پیدا میکند.
- در هر گروه از بالا به پایین، خاصیت فلزی افزایش مییابد.
- توانایی از دست دادن الکترون به خاصیت فلزی و توانایی دریافت الکترون به خاصیت نافلزی مرتبط است.
حالت فیزیکی عنصرها در جدول
بیشتر عنصرهای جدول در دما و فشار استاندارد محیط به صورت جامدند، تعدادی گازی و تنها دو عنصر برم و جیوه به صورت مایع یافت می شوند.
نحوه کار با شبیه ساز
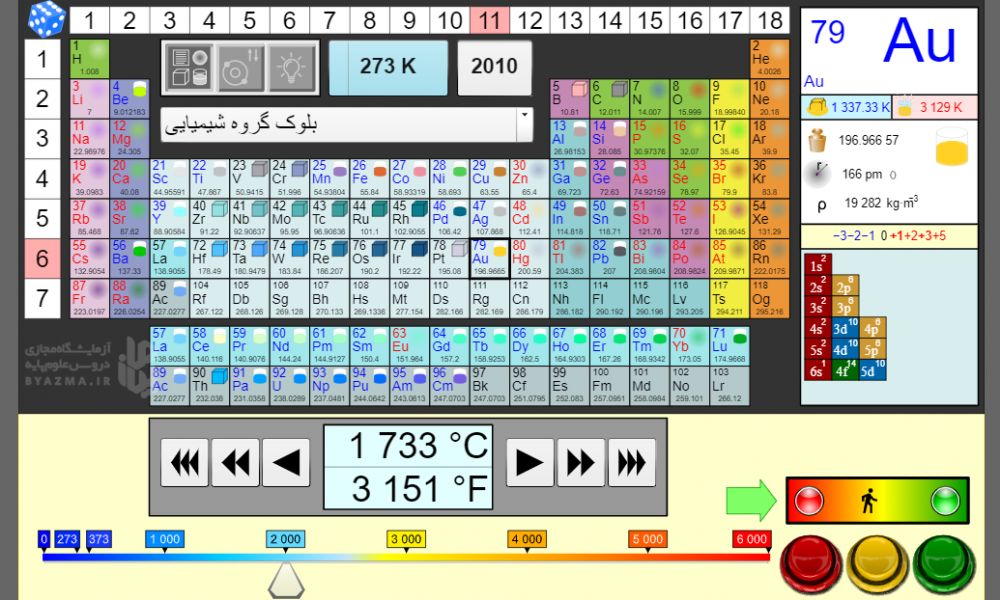
درشبیه ساز 118 عنصر جدول در 18 گروه و 7 دوره قرار گرفته اند. شما با کلیک بر روی هر کدام ازعصرها بلافاصله در قسمت راست و بالای جدول می توانید نماد شیمیایی- عدداتمی- نقطه ذوب- نقطه جوش- جرم اتمی- حالت فیزیکی(جامد، مایع یا گاز بودن به صورت شکل)- چگالی- شعاع اتمی-حالت های مختلف عدد اکسایش- سال کشف و آرایش الکترونی آن را ملاحظه نمایید.
در شبیه ساز سه دکمه در قسمت بالا سمت چپ قرار گرفته
با کلیک بر روی اولین دکمه از سمت چپ شما می توانید حالت فیزیکی عنصر مورد نظر خود را در دماهای مختلف رویت کنید. شبیه ساز این قابلیت را دارد که دمای منتخب شما را علاوه بر مقیاس سانتیگراد در مقیاس درجه بندی فارنهایت و کلوین نیز نشان دهد.
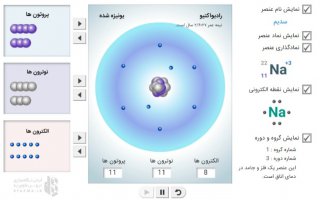
با کلیک بر روی دومین دکمه(دکمه وسط) آرایش الکترونی عنصر مورد نظر در پایین جدول نمایش داده می شود. دقت کنید آرایش الکترونی عناصر کمی با آنچه امروزه در کتابهای درسی می خوانید متفاوت است . دلیلش هم نشان دادن اسپین یاجهت چرخش الکترون در زیر لایه مورد نظر است .( فلش روبه بالا یعنی الکترون در جهت عقربه های ساعت و فلش روبه پایین یعنی در خلاف جهت عقربه های ساعت می چرخد.)
دکمه سوم نشان می دهد در بازه زمانی سالهای 1672 الی 2010 میلادی چه تعداد وچه عنصرهای جدول توسط دانشمندان کشف شده است.
یک کشو هم زیر سه دکمه تعبیه شده،کشو را که باز کنید با آیتم های (بلوک گروه شیمیایی- جرم اتمی- آرایش الکترونی- عدد اکسایش- شعاع اتمی- نقطه ذوب- نقطه جوش- چگالی و سال کشف عنصر)مواجه می شوید.
جالب اینجاست که می توانید با انتخاب کل 118 عنصر جدول و هر کدام از آیتم های داخل کشو اطلاعات مربوط به کل عناصر را یکجا رویت کنید. یادتون باشد سه دکمه رنگی سبز، زرد و قرمز هم در پایین سمت راست جدول تعبیه شدند تا آیتم های انتخابی شما را جلو وعقب ببرند.
بعنوان مثال روی عنصر شماره 21 کلیک کنید. بلافاصله در سمت راست مشخصات Sc نمایش داده می شود. عدد اتمی 21، نقطه ذوب 1814K، نقطه جوش 3109K، جرم اتمی 44/955gr، حالت فیزیکی جامد، شعاع اتمی 211pm، چگالی 2990Kg.m -3، اعداد اکسایش 0+1+2+3، سال کشف 1879 و آرایش الکترونی:
| | | | | | | |
اسکاندیم در دمای صفر مطلق یا صفر کلوین (معادل یا ) به صورت جامد و در حد واسط دماهای 1814K تا 3109K که نقطه ذوب و جوش اسکاندیم است به صورت مایع و در دماهای بالاتر از 3109K به صورت گاز در می آید.
سوالات
۱-مشخصات فیزیکی عنصر شماره 81 جدول را پیدا کنید؟
۲-آیا درسال 1850 میلادی 58 عنصر کشف شده بود؟
۳-نام عنصرهایی که تا سال 1710 میلادی کشف شده بودند را بیان کنید؟
۴-عنصر Sn در کجای جدول تناوبی قرار دارد؟ در دمای 1200Kبه چه حالت فیزیکی یافت می شود؟
۵-تنوع اعداد اکسایش در عنصر فلوئور (F) بیشتر است یا گوگرد (S)؟
- آشنایی با ۱۱۸ عنصر موجود در جدول تناوبی و سال کشف هریک
- مطالعه نحوی چینش و طبقه بندی عناصر در جدول تناوبی
- درک آرایش الکترونی و اعداد اکسایش هر عنصر
- آشنایی با خواص فیزیکی عناصر(نقطه ذوب- نقطه جوش- چگالی- جرم اتمی)
- شناخت حالت فیزیکی هر عنصر در دماهای مختلف با مقیاس سانتیگراد، فارنهایت و کلوین



ماهان بنایی
ماهان بنایی
علی کرمی
خیر، تولید مجموعه بیازما هستش
اگر از PHET استفاده کرده باشیم حتما لوگو فت در شبیهساز قرار داده شده و کپی رایت رعایت می شود.
سید کمال پورصالحان
خیلی عالی.
این نرم افزار رو از کجا میتونم تهیه کنم
شهره امیرقلی