اتم: واحد اصلی ماده
اتم کوچکترین ذره یک عنصر است که تمام خصوصیات آن را دارد.
اتم ها از ذرات کوچکتری به نام پروتون، نوترون و الکترون تشکیل شده اند. الکترون های کوچکتر به دور هسته مرکزی پروتون و نوترون می چرخند.
الکترون: ذره ای با بار منفی که در اطراف هسته حرکت می کند. جرم یک الکترون کمتر از یک هزارم جرم یک پروتون است.
پروتون: یک ذره با بار مثبت که در هسته یک اتم قرار دارد. جرم پروتون ها کمی کمتر از نوترون هاست. تعداد پروتون ها عنصر را تعیین می کند.
نوترون: ذره ای بدون بار که در هسته اتم قرار دارد. جرم نوترون ها کمی بیشتر از پروتون هاست.
تعداد نوترون ها با عدد نوترونی N توصیف می شود.
برای هر اتم، عدد اتمی و عدد جرمی تعریف می شود:
عدد اتمی:
تعداد پروتون های موجود در هسته یک اتم
عناصر با عدد اتمی از یکدیگر متمایز می شوند. برای مثال، هر اتمی با دو پروتون، اتم هلیوم است.
نماد عدد اتمی Z است. در نماد عنصر، عدد اتمی در پایین سمت چپ نشان داده شده است.
عدد جرمی:
تعداد پروتون ها به اضافه نوترون ها در هسته یک اتم
به عنوان مثال، عدد جرمی هلیوم 4 است. (2 پروتون و 2 نوترون)
نماد عدد جرمی A است. در نماد عنصر، عدد جرمی در بالا سمت چپ نشان داده شده است.
نکته: برای یافتن تعداد نوترون ها، عدد اتمی را از عدد جرمی کم کنید.
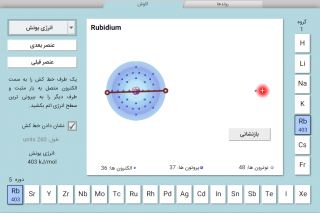
برای نمایش ساختار یک اتم از نمودار الکترون-نقطه ای استفاده می شود، که نماد عنصر در وسط و با نقاطی احاطه شده است که نشان دهنده الکترون های ظرفیت است. ( الکترون های ظرفیت؛ الکترون هایی هستند که در بیرونی ترین سطح انرژی یک اتم قرار دارند.)
عنصر:
یک ماده خالص است که نمی توان آن را به مواد سادهتر با وسایل شیمیایی معمولی تجزیه کرد.
عناصر از یک نوع اتم ساخته شده اند. اتم های عناصر مختلف در تعداد پروتون با هم تفاوت دارند به عنوان مثال، تمام اتم های کربن دارای 6 پروتون هستند.
عناصر شیمیایی در جدولی به نام جدول تناوبی عناصر براساس خواص کنار هم چیده می شوند.
اگر تعداد الکترون های یک اتم را کم یا زیاد کرد آن اتم به یون تبدیل می شود اتمی با پروتون های بیشتر از الکترون ها یک یون بار مثبت یا کاتیون است. اتمی که الکترون های بیشتری نسبت به پروتون دارد، یک یون با بار منفی یا آنیون می باشد.
در نماد عنصر، بار الکتریکی در سمت راست بالا نشان داده شده است.
ایزوتوپ:
همه ایزوتوپ های یک عنصر معین دارای تعداد پروتون یکسانی هستند، اما در تعداد نوترونها با هم تفاوت دارند. بیشتر ایزوتوپ ها رادیواکتیو هستند. معمولاً فقط یک یا دو ایزوتوپ پایدار برای یک عنصر معین وجود دارد.
رادیواکتیو:
در یک اتم رادیواکتیو، هسته می تواند به طور خود به خود تجزیه شود و ذرات و/یا نور ساطع کند. این انتشارات را رادیواکتیو می نامند. انرژی آزاد شده توسط مواد رادیواکتیو را می توان برای تولید برق در یک نیروگاه هسته ای مهار کرد. از این انرژی می توان برای ایجاد یک انفجار عظیم در یک بمب هسته ای مورد استفاده قرار گیرد.
اگر انتشار تعداد پروتون های هسته را تغییر دهد، ماده به عنصر دیگری تبدیل می شود.
نحوه کار با شبیه ساز
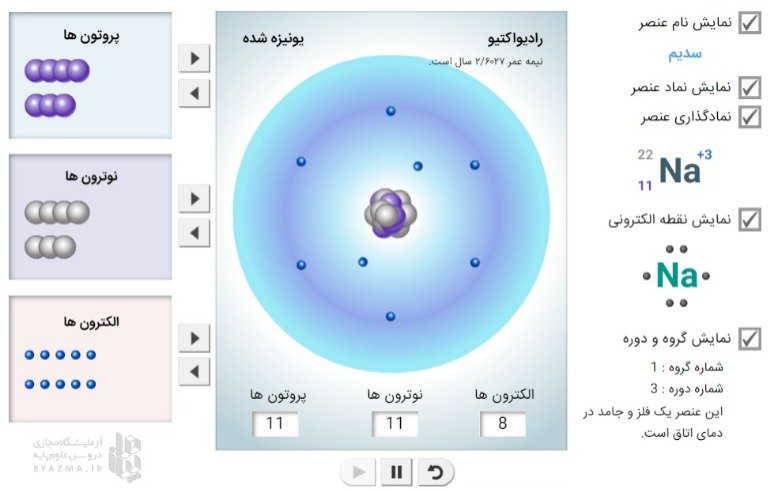
با این شبیه ساز خودتان اتم بسازید:
برای ساختن عناصر از پروتون، نوترون و الکترون استفاده کنید. با تغییر تعداد پروتون ها، نوترون ها و الکترون ها، اطلاعاتی مانند نام و نماد عنصر، اعداد Z، N و A، نمودار نقطه الکترونی، گروه و دوره از جدول تناوبی نشان داده می شود. هر عنصر به عنوان فلز، متالوئید یا نافلز طبقه بندی می شود و حالت آن در دمای اتاق نیز مشخص شده است.
شبیه ساز یک اتم را با یک پروتون نشان می دهد. پروتون در مرکز اتم به نام هسته قرار دارد.
از دکمه های جهت دار برای افزودن پروتون، نوترون و الکترون به اتم استفاده کرده و گزینه پخش را فشار دهید.
- الف- کدام ذرات در هسته قرار دارند؟
- ب- کدام ذرات به دور هسته می چرخند؟
آیتم های سمت راست شبیه ساز:
با فعال کردن دکمه نمایش نام عنصر، نام عنصر را می توانید مشاهده کنید.
با فعال کردن دکمه نمایش نماد عنصر، نماد شیمایی آن قابل مشاهده است.
با فعال کردن دکمه نمایش ساختار نقطه الکترونی ، این ساختار را ببینید.
و با فعال کردن نمایش دوره و گروه می توان دوره و گروه عنصری که ساخته اید را مشاهده کنید.
در پایین این قسمت فلز، شبه فلز یا نافلز بودن عنصر را می توانید ببینید.
فعالیت:
یک اتم لیتیوم (3 پروتون، 4 نوترون، 3 الکترون) ایجاد کنید.
- چند الکترون ظرفیتی در یک اتم لیتیوم خنثی وجود دارد؟
- نمودار نقطه الکترونی را برای لیتیوم خنثی رسم کنید.
- کدام عنصر خواصی مشابه لیتیوم دارد؟
- آشنایی با ساختار اتم
- بررسی اجزای سازنده اتم
- آشنایی با مفاهیم اصلی در رابطه با اتم و عنصر
- شناسایی ایزوتوپ
- مقایسه ایزوتوپ های مختلف یک عنصر
- بررسی دوره و گروه عناصر
- بررسی و پیدا کردن عدد اتمی و عدد جرمی عناصر



سعید
۱۵ دی ۱۴۰۴علی کرمی
نمیتوان پاسخ دقیق داد. بستگی به تلاطم آب، چگالی آب، ابعاد طلا، نحوه رها کردن آن و... دارد.
آرین
۸ دی ۱۴۰۳نسرین فرشادی
طرح هرگونه پرسش از محتوای «آیا میدانید» و «در میان تارنما» در آزمونهای هماهنگ کشوری، نهایی و کنکور سراسری ممنوع است.
پس در امتحانات هماهنگ، طرح سوال از آیا میدانیدها ممنوع بود اما در امتحانات داخلی چیزی در این مورد گفته نشده است.
نفس
۴ آذر ۱۴۰۳علی کرمی
فاطمه زهرا
۲ آذر ۱۴۰۳علی کرمی
ساخت اتم:
https://byazma.ir/page/181
مدل اتمی۱:
https://byazma.ir/page/157
مدل اتمی۲:
https://byazma.ir/page/26
کیمیا
۱۰ آذر ۱۴۰۲علی کرمی
کیمیا
۱۰ آذر ۱۴۰۲