برای اندازه گیری جرم یک جسم باید وزنه و مقیاس به کار رفته متناسب با اندازه آن جسم باشد، مثلا باسکول های چند تنی برای اندازه گیری جرم یک هندوانه مناسب نیستند، چون دقت آنها در حد تن است و همینطور یک وزنه کیلوگرمی برای اندازه گیری جرم یک دانه برنج مناسب نیست. اتم ها و مولکول ها دارای جرم های بسیار کم هستند.
یکای مناسب برای اندازه گیری جرم اتم، باید کمیتی از جنس خود اتم ها باشد.
یکای انتخاب شده در این مورد که به نام واحد کربنی خوانده شده و با نماد
amu (Atimic Mass Unit) نمایش داده می شود.
به یک دوازدهم جرم اتم کربن 12 یک amu می گویند که یکای سنجش جرم اتم ها و مولکول هاست.
جرم اتمی یک عنصر نشان می دهد که یک اتم از آن عنصر چند بار سنگین تر از واحد جرم اتمی است.
مثلا وقتی میگوئیم جرم اتمی گوگرد 32amu است، یعنی یک اتم گوگرد 32 بار از واحد جرم اتمی سنگینتر است.
الکترون و پروتون را ذره های زیر اتمی می نامند (البته تنها الکترون ذره بنیادی است) و نوترون بنیادی نیست. بنابراین در این مقیاس، جرم پروتون و نوترون تقریبا 1amu و الکترون تقریبا 0.0005amu فرض می شود.
نکته: یک amu را یک دالتون (D) در نظر میگیرند.
با وجودی که در بسیاری از مسائل، جرم اتمی برابر عدد جرمی فرض می شود، این دو کمیت با یکدیگر متفاوت اند.
تفاوت عدد جرمی با جرم اتمی:
عدد جرمی یک عدد صحیح است که شمار نوکلئون ها (مجموع تعداد نوترون و پروتون) را نشان می دهد. این عدد در سمت چپ و بالای نماد شیمیایی عنصر نوشته می شود. در حالی که جرم اتمی، جرم یک اتم را بر حسب نشان می دهد. به همین دلیل عدد صحیحی نیست.
برای تبدیل یکای amu به یکای گرم، از مفهوم مول و عدد آووگادرو کمک گرفتند، می دانیم که یک مول از هر ذره یعنی 1023×6/022 اتم از آن ذره
یک مول اتم یعنی 1023×6/022 اتم از اتم کربن–12، جرمی برابر یک گرم دارد. بنابراین جرم یک مول اتم کربن–12 برابر است با:
در واقع اگر یک واحد جرم اتمی (amu) را در عدد آووگادرو ضرب کنیم، تبدیل به گرم می شود:
1amu × 6.022×1023 = 1gr
به دو دلیل برای اتم ها جرم اتمی میانگین گزارش می شود:
- اتم های یک عنصر، ایزوتوپهای مختلف دارند.
- فراوانی ایزوتوپهای آن ها متفاوت است. این مطلب یکی از دلایل اعشاری شدن جرمهای اتمی است.
محاسبه جرم مولی ترکیب شیمیایی
... + (جرم مولی) × تعداد عنصر دوم + (جرم مولی) × تعداد عنصر اول = جرم مولی ترکیب
مثال:
H2O : H=1.008 gr/mol , O=15.999 gr/mol
مول/گرم 18.015 = (15.999)1 + (1.008)2=جرم مولی آب
نحوه کار با شبیه ساز
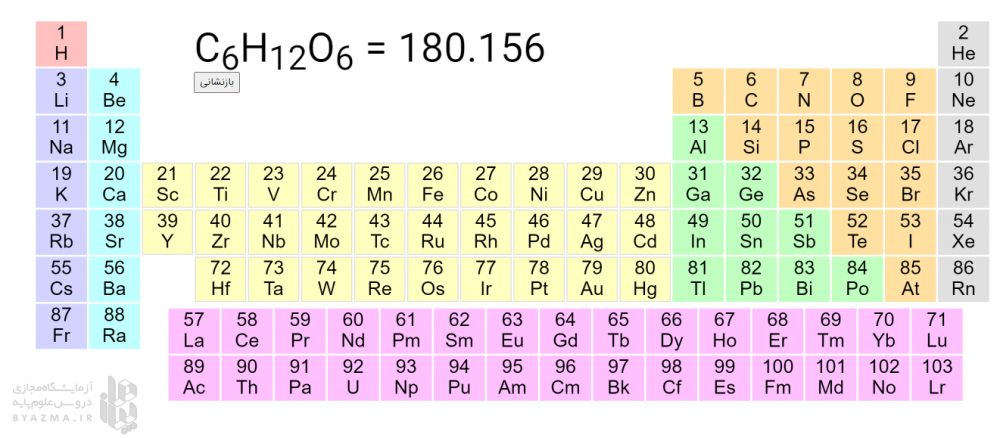
چنانچه روی هر کدام از خانه های جدول کلیک کنید، جرم اتمی میانگین عنصر مورد نظر به صورت یک عدد اعشاری نمایش داده می شود.
می توانید با کلیک بر روی اتم های سازنده ترکیب شیمیایی مورد نظرتان جرم مولی آن را بلافاصله ببینید. مثلا برای نمایش جرم مولی آب (H2O) دوبار روی H و یکبار روی O کلیک نمایید.عدد 18.015 نمایش داده می شود. اگر برای این عدد یکای amu در نظر بگیریم یعنی یک مولکول 18.015amu ،H2O جرم دارد و اگر برای این عدد یکای گرم در نظر بگیریم یعنی یک مول 18.015gr ،H2O جرم دارد. دقت کنید اعداد بدست آمده به صورت اعشار هستند و ما در محاسبات این اعداد را به نزدیک ترین عدد صحیح گرد می کنیم.
برای نمایش جرم مولکول گلوکز C6H12O6 کافی است 6 بار روی اتم C و 12 بار روی اتم H و 6 بار روی اتم O کلیک نمایید. (بطور کلی به تعداد زیروندهای هر اتم روی آن کلیک کنید.)
شما می توانید جرم هر مولکول یا هر ترکیب یونی مورد نظر خود را با این روش بلافاصله مشاهده نمایید.
پس از نمایش جرم مولی ترکیب مورد نظر می توانید روی عبارت باز نشانی کلیک کرده و ترکیب جدیدی را بسازید و جرم آن را ببینید.
یادتان باشد به کمک این نرم افزار جرم تمام ترکیباتی که می سازید نمایش داده می شود ولی ممکن است ترکیب ساخته شده توسط شما وجود خارجی نداشته باشد.
بعنوان مثال اگر دوبار روی Sr و یکبار روی Y کلیک کنید ترکیب Sr2Y ساخته شده و جرم 264.146 نمایش داده می شود اما این ماده اصلا وجود ندارد.
سوالات
۱- جرم مولکول CO2 را تعیین کنید.
۲- آیا جرم مولی Al2O3 حدود ۱۰۲ محاسبه می شود؟
۳- جرم یک مول ترکیب Cr2(CO3)3 را چگونه تعیین کنیم؟
- آشنایی با یکای اندازه گیری جرم اتم ها
- مهارت ساخت انواع ترکیبات
- محاسبه جرم مولی ترکیبات شیمیایی
- درک اعشاری بودن جرم اتمی عناصر


عاطفه
۳ آذر ۱۴۰۳فاطمه عبدی سادات
۲ اسفند ۱۴۰۱علی کرمی
خوشحالیم که شبیه ساز برای شما مفید بوده
پاینده باشید.