پیوند یونی نوعی پیوند شیمیایی است که شامل جاذبه الکترواستاتیکی بین یونهای دارای بار مخالف یا بین دو اتم با الکترونگاتیوهای کاملاً متفاوت است. این پیوند بین یک فلز و نافلز رخ می دهد، زیرا تمایل زیاد فلزات به از دست دادن الکترون و همچنین تمايل بالای نافلزات برای گرفتن الكترون سبب سهولت در ايجاد يون ها مثبت و منفی و در نتیجه تشکیل پیوند یونی می گردد.
این پیوند پایه ترکیبات یونی است. ترکیبات یونی از تعداد زیادی آنیون و کاتیون تشکیل شده اند که با طرح معین هندسی در کنار هم قرار گرفتهاند و یک بلور به وجود میآورند.
وقتی اتمها به یون تبدیل میشوند، خواص آنها شدیداً تغییر میکند
دلیل انجام پیوند های یونی این است که اتم ها تمایل دارند که با رسیدن به آرایش گازهای نجیب (قاعده اکتت) به ساختار پایدار دست یابند. اتم هایی که در لایه ظرفیت خود تعداد کمی الکترون دارند، می توانند آن الکترون ها را به راحتی از دست بدهند و در مقابل اتم هایی که لایه ظرفیت شان تقریبا پر می باشد می توانند الکترون جذب نمایند. در این صورت هر دو اتم شرکت کننده در پیوند دارای یک لایه ظرفیت پر (هشت تایی) خواهند شد.
قابلیت شبیه سازT
شبیه ساز پیوندهای یونی به شما امکان می دهد نحوه تشکیل پیوندهای یونی را کشف کنید.
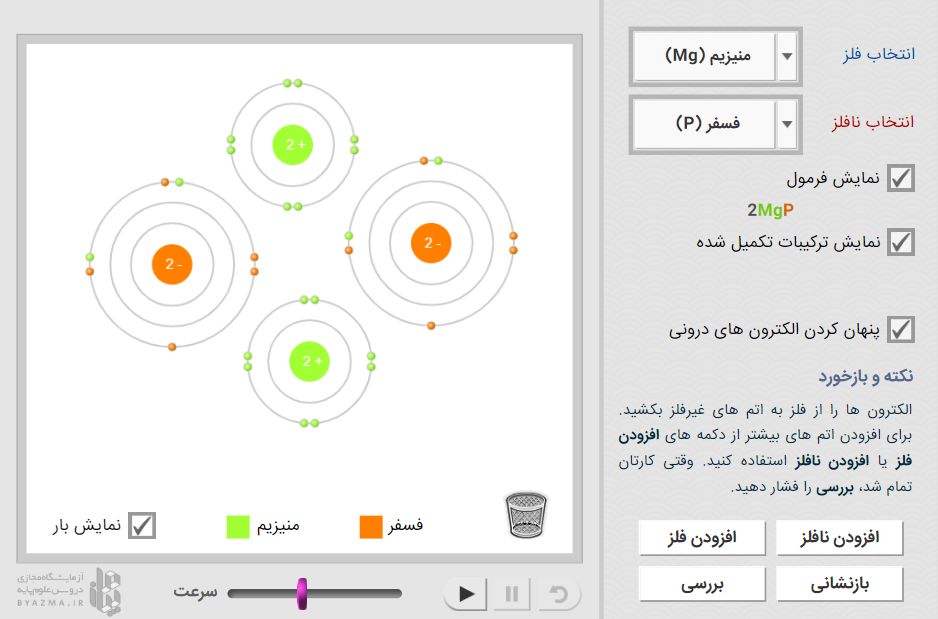
می توانید پیوندهای یونی بین انواع فلزات و نافلزات را شبیه سازی کنید. یک فلز و یک اتم نافلز را انتخاب کنید و الکترون ها را از یکی به دیگری انتقال دهید. تأثیر به دست آوردن و از دست دادن الکترون ها بر روی بار را مشاهده کنید و اتم ها را برای نمایش ساختار مولکولی مجدداً مرتب کنید. اتم های فلز و غیرفلز اضافی را می توان به صفحه نمایش اضافه کرد و فرمول شیمیایی حاصل را می توان نمایش داد.
نحوه کار شبیه ساز
با یک مثال شروع کنیم:
بررسی کنید که سدیم (Na) و کلر (Cl) از منوهای سمت راست انتخاب شده باشند. برای مشاهده الکترون هایی که به دور هسته هر اتم می چرخند، روی اجرا ( ) کلیک کنید. (توجه: این مدل های اتمی ساده شده اند و قرار نیست واقع بینانه باشند.)
1. هر اتم از یک هسته مرکزی و چندین پوسته که حاوی الکترون هستند تشکیل شده است. بیرونی ترین الکترون ها الکترون های ظرفیتی نامیده می شوند.
هر اتم چند الکترون ظرفیت دارد؟ سدیم: ______ کلر: ______
2. روی توقف کلیک کنید. عناصر را می توان به عنوان فلزات و غیر فلزات طبقه بندی کرد. فلزات الکترون های ظرفیت خود را خیلی محکم نگه نمی دارند، در حالی که نافلزات الکترون های خود را محکم نگه می دارند. میل الکترونی معیاری است که نشان می دهد الکترون های ظرفیت چقدر محکم نگه داشته می شوند.
الف) سعی کنید یک الکترون ظرفیتی را از هر اتم دور کنید. بر اساس این آزمایش کدام اتم فلز است؟ ________ کدام نافلز است؟ ________
ب) سعی کنید الکترون را از فلز به نافلز منتقل کنید. چه اتفاقی می افتد؟ ________
Save translation
برخی از ذرات تشکیل دهنده اتم ها دارای بار الکتریکی هستند. الکترون ها دارای بار منفی هستند، در حالی که پروتون ها دارای بار مثبت هستند. ذرات با بارهای مخالف (+ و –) جذب می شوند، در حالی که ذرات با بار یکسان (+ و + یا – و –) دفع می کنند.
وقتی اتم ها الکترون می گیرند یا از دست می دهند چه اتفاقی می افتد؟
1. شمارش: الکترون ها در اطراف هسته اتم ها در پوسته های خاص حرکت می کنند که با حلقه های اطراف اتم ها در شبیه ساز نشان داده شده است. حلقه اول، دو الکترون و حلقه دوم، هشت الکترون را در خود جای می دهد. (در صورت تمایل، می توانید با انتخاب مخفی کردن الکترون های داخلی، الکترون های داخلی را پنهان کنید.)
الف) اتم های سدیم و کلر را مشاهده کنید. در مجموع در هر اتم چند الکترون وجود دارد؟
سدیم: ________ کلر: ________
ب) هر اتم دارای بار خنثی است، به این معنی که هر اتم دارای تعداد پروتون و الکترون یکسانی است. بر این اساس در هر اتم چند پروتون وجود دارد؟
سدیم: ________ کلر: ________
2. مشاهده کنید: اکثر اتم ها با پیکربندی هشت الکترون ظرفیتی پایدار هستند. این به عنوان قانون هشتگانه شناخته می شود. هر اتم چند الکترون ظرفیت دارد؟
سدیم: _________ کلر: ________
3. تشکیل پیوند: هر الکترون دارای بار 1– و هر پروتون دارای بار 1+ است. شما می توانید بار یک اتم را با کم کردن تعداد الکترون ها از تعداد پروتون ها محاسبه کنید. حرکت الکترون از سدیم به اتم کلر.
الف) اکنون بارهای هر اتم چیست؟ سدیم: _____ کلر: _____
برای بررسی، نمایش بار را روشن کنید. این اتم های باردار یون نامیده می شوند.
ب) آیا هر یون پایدار است؟ توضیح دهید.
برای بررسی کردن پیوند روی گزینه "بررسی" در گوشه سمت راست پایین شبیه ساز کلیک کنید.
4. فکر کنید: چرا بین دو یون در این پیوند شیمیایی جاذبه وجود دارد؟
Translation is too long to be
ترکیبات یونی چگونه تشکیل می شوند؟
1. مشاهده کنید: به اتم لیتیم بنفش و اتم اکسیژن قرمز نگاه کنید. اکثر اتم ها زمانی پایدار هستند که بیرونی ترین حلقه آنها دارای هشت الکترون باشد. برخی از اتم ها مانند لیتیم و بریلیم زمانی پایدار هستند که بیرونی ترین حلقه آنها دارای دو الکترون باشد.
الف) اتم لیتیم برای پایدار شدن چند الکترون از دست می دهد؟
ب) اتم اکسیژن برای پایدار شدن به چند الکترون نیاز دارد؟
ج) آیا می توان از این دو اتم یک ترکیب پایدار ساخت؟ توضیح دهید چرا یا چرا؟
2. تشکیل پیوند: روی افزودن فلز کلیک کنید تا یک اتم لیتیم دیگر اضافه شود و سپس الکترون ها را از لیتیم به اکسیژن منتقل کنید. روی بررسی کلیک کنید.
الف) آیا یک ترکیب پایدار ساختید؟
ب) نمایش فرمول را روشن کنید. فرمول این ترکیب چیست؟
ج) نمایش بار را روشن کنید. بار هر یون چقدر است؟ لیتیم _____ اکسیژن ______
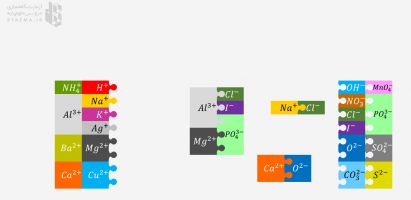
3. تمرین: از شبیه ساز برای ایجاد ترکیبات پایدار از ترکیبات زیر استفاده کنید. پس از انتقال الکترون ها، اتم ها را مرتب کنید تا جاذبه بین یون های دارای بار مثبت و یون های دارای بار منفی را نشان دهند. برای بررسی هر ترکیب روی گزینه بررسی کلیک کنید.
| نام یون ها | نماد یون ها | بار | فرمول شیمیایی | |
| 1 | لیتیوم فلوئور | LI F | + - | |
| 2 | بریلیم اکسیژن | O Be | ||
| 3 | منیزیم فلوئور | Mg F | ||
| 4 | آلومینیوم کلر | Al Cl | ||
| 5 | بریلیم نیتروژن | Be N |
- آشنایی با ساختار فلز و نافلز
- شناسایی تفاوت آنیون کاتیون
- آشنایی با ساختار لایه ای اتم ها
- به دست آوردن فرمول ترکیبات یونی
- بررسی پیوند یونی و تشکیل ترکیبات یونی


حسن کرامتلو
۷ آبان ۱۴۰۴نسرین فرشادی
الکترونهای آزاد شده از فلزات در خاک معمولاً وارد واکنشهای اکسایش-کاهش میشوند، نه اینکه مستقیماً توسط نافلزها جذب شوند. برای جذب مؤثر الکترون توسط نافلز، باید شرایط آزمایشگاهی یا محیطی خاصی فراهم شود (مثل محلول الکترولیت یا محیط آبی با یونهای فلزی).
موفق باشید.
♡♡
۹ دی ۱۴۰۱علی کرمی
ماهور
۹ دی ۱۴۰۱علی کرمی
شبیه ساز اگر ترکیب را به درستی بسازید فرمول را به شما خواهد داد.
زینب
۹ دی ۱۴۰۱علی کرمی
اسلای
۶ دی ۱۴۰۱