بیازماییها سلام!
ضمن آرزوی شادی و سلامتی در سال 1403برای شما، در این شبیه ساز قصد داریم تا با قطبیت پیوند و قطبیت ترکیبات شیمیایی آشنا شویم.
معرفی
ترکیبات یونی و ترکیبات مولکولی، دستهای از ترکیبات شیمیایی هستند.
ترکیبات یونی: از تشکیل پیوند یونی بین یونهای مثبت (کاتیونها) و یونهای منفی (آنیونها) به وجود آمدهاند. برای یادآوری و یادگیری بیشتر به شبیه ساز ترکیب یونی و شبیه ساز پیوند یونی مراجعه کنید.
ترکیبات مولکولی: از تشکیل جاذبه بین مولکولها به وجود آمدهاند. مولکولها نیز از ایجاد پیوند کووالانسی (به اشترک گذاشتن الکترونهای لایه ظرفیت) بین اتمها به وجود میآیند. برای یادآوری و یادگیری بیشتر به شبیه ساز پیوند کووالانسی و شبیه ساز آشنایی با مولکولها مراجعه کنید.
- پیوند قطبی یا دو قطبی: در اتمها، خاصیتی ذاتی به نام "الکترونگاتیوی" وجود دارد. گاهی به جای واژه الکترونگاتیوی، واژه الکترون دوستی را هم بکار میبرند. حال منظور از این واژه چیست؟ وقتی دو اتم با یکدیگر تشکیل پیوند میدهند، بین آنها پیوند (الکترونهای پیوندی) وجود دارد. اتمی که الکترونگاتیوتر است، زورگوتر بوده و دوست دارد که این الکترونهای پیوندی را به سمت خودش بکشد و به اصطلاح میگوییم، ابر الکترونی پیوند را به سمت خودش میکشد. وقتی ابر الکترونی پیوند، از یک اتم دور شود و به اتم زورگو (اتم الکترونگاتیوتر) نزدیک شود، پیوند قطبی ایجاد خواهد شد. هر چه تفاوت الکترونگاتیوی دو اتم بیشتر باشد، پیوند قطبیتر است. وقتی که ابر الکترونی پیوند از اتم کم زور دور میشود؛ این اتم، جزئی بار مثبت (+δ) پیدا میکند و وقتی که اتم پر زور، ابر الکترونی پیوند را به سمت خودش میکشد؛ این اتم، جزئی بار منفی (-δ) پیدا میکند. در واقع در یک پیوند قطبی، ابر الکترونی به صورت متقارن پراکنده نشده است چون این ابر به اتم زورگو نزدیک شده است و از اتم کم زور دور شده است.
توجه: اگر اختلاف زور (الکترونگاتیوی) دو اتم درگیر در پیوند، بین عدد 0.4 تا 1.67 باشد، آن پیوند، کووالانسی قطبی است.
نکته: پس تا اینجا منظور از قطب داشتن، داشتن بخشهایی است که بارهای مخالف داشته باشند.
- یون: گاهی انقدر یک اتم نسبت به دیگری پرزورتر است که الکترونهای پیوند را کلا جدا میکند و برای خودش برمیدارد که در این حالت میگوییم این اتم پرزور، بار منفی پیدا کرده و تبدیل به آنیون (یون منفی) شده و اتم کم زور مقابلش، بار مثبت پیدا کرده و تبدیل به کاتیون (یون مثبت) میشود.
توجه: اگر اختلاف زور (الکترونگاتیوی) دو اتم درگیر در پیوند، بزرگتر یا مساوی عدد 1.67 باشد، آن پیوند، یونی است.
- پیوند ناقطبی یا غیرقطبی: اگر زور (الکترونگاتیوی) هر دو اتم مانند هم یا در حد هم باشد، پیوند بینشان (ابر الکترونی پیوند) کشیده نمیشود و به صورت متقارن پراکنده میشود؛ در نتیجه قطبی ایجاد نمیشود و پیوند حاصل، ناقطبی خواهد شد.
توجه: اگر اختلاف زور (الکترونگاتیوی) دو اتم درگیر در پیوند، کوچکتر یا مساوی عدد 0.4 باشد، آن پیوند، کووالانسی ناقطبی است.
حال به سراغ مولکول قطبی و ناقطبی برویم ...
- مولکول قطبی یا دو قطبی: مولکولی است که دارای پیوندهای قطبی است و این مولکول در میدان الکتریکی جهت گیری میکند؛ یعنی، سر یا قطب منفی مولکول (جزئی بار منفی) به سمت قطب مثبت میدان و سر مثبت مولکول (جزئی بار مثبت) به سمت قطب منفی میدان میچرخد. در مولکول قطبی الکترونها به صورت متقارن در مولکول، توزیع نشده اند.
نکته: ترکیبات یونی، برای ترکیبات یونی به طور مجزا، بار مثبت و منفی تعریف میشود و دیگر جزئی بار مثبت و منفی نمیگوییم.
- مولکول ناقطبی یا غیرقطبی: مولکولی است که میتواند دارای پیوندهای قطبی (!) و ناقطبی باشد. این مولکول در میدان الکتریکی جهت گیری نمیکند چون قطب ندارد. در مولکول ناقطبی الکترونها به صورت متقارن در مولکول، توزیع شده اند.
نکته: اگر پیوندهای قطبی در یک مولکول طوری قرار گرفته باشند که بار آنها یکدیگر را خنثی کند؛ در نتیجه مولکول، ناقطبی خواهد شد.
نحوه کار با شبیه ساز
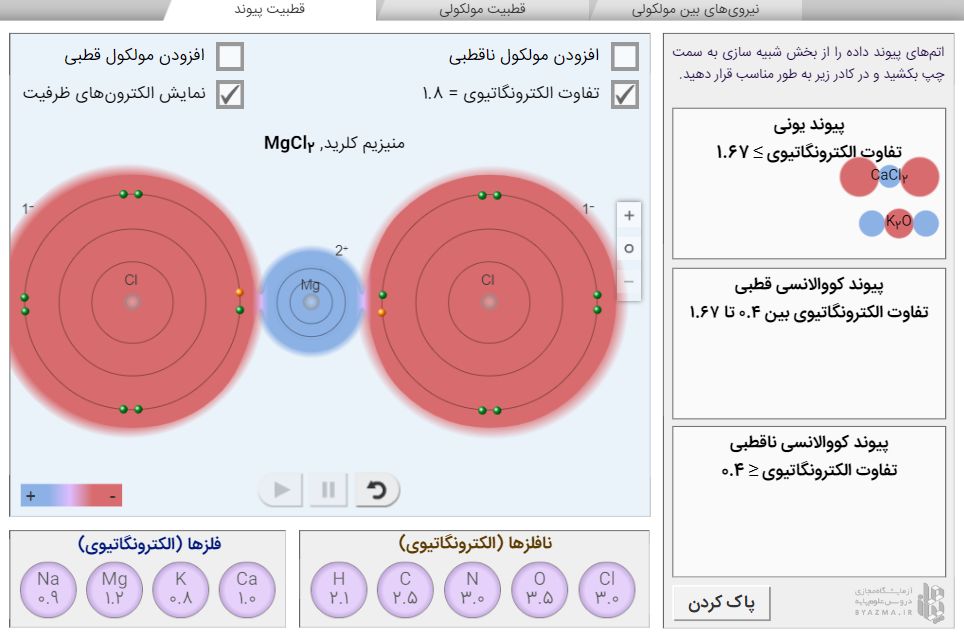
برای شروع کلیک کنید. از نوار بالای شبیه ساز قطبیت پیوند را انتخاب کنید. با انتخاب این بخش، تعدادی اتم فلز و نافلز در پایین صفحه برای شما نمایش داده که الکترونگاتیوی هر اتم در زیر آن نوشته شده است.
با انتخاب یک فلز و یک نافلز، یا دو نافلز، شبیه ساز به طور هوشمند برای شما، ترکیب یونی یا مولکول حاصل از اتمهایی که انتخاب کردهاید را می سازد. برای مثال انتخاب اتم N و اتم H را جداگانه از بخش نافلزها انتخاب کنید و به وسط صفحه بکشید؛ خواهید دید که ترکیب شیمیایی که میتواند از این دو نوع اتم تشکیل شود، مولکول NH3 میباشد. نام این مولکول هم علاوه بر فرمول شیمیایی برای شما نمایش داده میشود. حال به مولکول NH3 توجه کنید. توزیع ابرالکترونی در این مولکول، متقارن نیست؛ چون زور (الکترونگاتیوی) اتم N بیشتر از Hها است، الکترونهای پیوندی را به سمت خود میکشد در نتیجه ابر دورش (ابر قرمز رنگ) بزرگتر از ابر اطراف Hها میشود (ابر آبی رنگ) و N دارای جزئی بار منفی (-δ) میشود و Hها دارای جزئی بار مثبت (+δ) که یعنی این مولکول قطبی است.
- یادآوری: منظور از الکترونهای پیوندی، الکترونهایی بود که اتم N و H با هم به اشتراک گذاشته بودند و تشکیل پیوند کووالانسی داده بودند.
با فعال کردن تیک "تفاوت الکترونگاتیوی" و "نمایش الکترونهای لایه ظرفیت"، میتوانید اختلاف الکترونگاتیوی پیوند N-H و نحوه به اشتراک گذاشتن الکترونهای لایه ظرفیت (لایه آخر) را بین اتمها برای تشکیل پیوند مشاهده کنید.
اختلاف الکترونگاتیوی پیوند N-H در مولکول NH3 عدد 0.9 میباشد. حال به سمت راست شبیه ساز توجه کنید، باتوجه به این عدد، مولکول را در دسته درست قرار دهید. در صورت دسته بندی درست، در پایین دستهها واژه "درست" ظاهر میشود.
- سوال1: اتم Ca و Cl را انتخاب کنید. چه نوع ترکیبی با این دو نوع اتم ساخته میشود؟ نام و فرمول شیمیایی این ترکیب چیست؟
- سوال2: اتم C و H را انتخاب کنید. چه نوع ترکیبی با این دو نوع اتم ساخته میشود؟ ترکیب حاصل، با توجه به اختلاف الکترونگاتیوی پیوندها، در کدام دسته قرار میگیرد؟
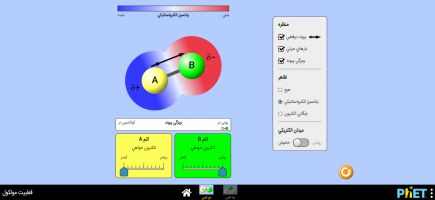
از نوار بالای شبیهساز قطبیت مولکولی را انتخاب کنید. با انتخاب این بخش، در وسط صفحه یک میدان الکتریکی با قطب مثبت و منفی ظاهر میشود. در پایین صفحه تعدادی مولکول که دارای پیوند قطبی و ناقطبی هستند نشان داده شده. یک مولکول را برداشته و به وسط میدان بکشید، با فشردن دکمه "فعال کردن میدان الکتریکی"، مشاهده کنید که آیا مولکول شما در میدان جهت گیری میکند یا نمیکند.
با فشردن دکمه "میدان برعکس" جای قطب مثبت و منفی میدان برعکس شده و جهت گیری هم برعکس میشود.
- یادآوری: مولکول قطبی در میدان الکتریکی جهت گیری میکند؛ یعنی، سر یا قطب منفی مولکول (جزئی بار منفی) به سمت قطب مثبت میدان و سر مثبت مولکول (جزئی بار مثبت) به سمت قطب منفی میدان میچرخد. در مولکول قطبی الکترونها به صورت متقارن در مولکول، توزیع نشده اند. مولکول ناقطبی در میدان الکتریکی جهت گیری نمیکند چون قطب ندارد.
با فعال کردن تیک "نمایش الکترونهای لایه ظرفیت"، نحوه به اشتراک گذاشتن الکترونهای لایه ظرفیت (لایه آخر) را بین اتمها برای تشکیل پیوند مشاهده کنید.
حال به سمت راست شبیهساز توجه کنید. باتوجه به جهت گیری، مولکولها را در دسته درست قرار دهید. در صورت دسته بندی درست، در پایین دستهها واژه "درست" ظاهر میشود.
- سوال چالشی: مولکول CCl4 را انتخاب کنید، این مولکول دارای پیوندهای قطبی است. آیا مولکولی قطبی میباشد؟ تفسیر کنید.
از نوار بالای شبیهساز نیروهای بین مولکولی را انتخاب کنید. با انتخاب این بخش، در پایین صفحه تعدادی مولکول قطبی و ناقطبی، نشان داده میشود. به دلخواه دو مولکول انتخاب کنید و به وسط صفحه بکشید. دکمه play یا مثلث() را بزنید و آنچه که بین مولکولها برقرار میشود را مشاهده کنید.
به نیروی جاذبه بین مولکولها، نیروی واندروالسی گفته میشود که انواع مختلفی دارد.
- نیروی جاذبه دوقطبی-دوقطبی: نیرو جاذبه بین مولکولهای قطبی است که در این حالت بین قطب منفی یک مولکول و قطب مثبت مولکول دیگر، جاذبه برقرار میشود.
- نیروی جاذبه دوقطبی-دوقطبی القایی: نیرو جاذبه بین مولکولهای قطبی و ناقطبی است که در این حالت وقتی مولکول ناقطبی، در مقابل میدان الکتریکی (سرهای مثبت و منفی) مولکول قطبی قرار میگیرد، بار مثبت و منفی القایی پیدا میکند که به اصطلاح میگوییم، بطور القایی دارای بار جزئی مثبت و منفی میشود.
- نیروی جاذبه لُندُن یا لاندُن: نیرو جاذبه بین مولکولهای ناقطبی است که در این حالت در یک لحظه، ابر الکترونی مولکول ناقطبی، طوری تغییر شکل پیدا میکند که یک سمت آن نسبت به سمت دیگر منفیتر شده پس قطب جزئی منفی و مثبت ایجاد میشود. این دوقطبی به وجود آمده، به مولکولهای نزدیک خود القا شده و آنها هم دوقطبی لحظهای میشوند؛ سپس، قطبهای مخالف در مولکولها یکدیگر را جذب میکنند. دقت شود که در لحظهای دیگر ممکن است که جهت دوقطبی تغییر کند.
حال به سمت راست شبیهساز توجه کنید، باتوجه به نیروهای جاذبه بین مولکولی، مولکولها را در دسته درست قرار دهید. در صورت دسته بندی درست، در پایین دستهها واژه "درست" ظاهر میشود.
امیدوارم که از این شبیه ساز جذاب و پرنکته، لذت برده باشید.
- آشنایی با ترکیبات یونی و مولکولی
- آموزش پیوندهای قطبی و ناقطبی
- آموزش مولکولهای قطبی و ناقطبی
- تشخیص پیوندهای قطبی و ناقطبی
- دسته بندی مولکولهای قطبی و ناقطبی
- بررسی نحوه به اشتراک گذاشتن الکترونهای ظرفیتی
- بررسی نحوه جهت گیری مولکولها در میدان الکتریکی
- معرفی و تشخیص نیروی جاذبه بین مولکولهای قطبی و ناقطبی


لیلا
۳ خرداد ۱۴۰۳نیکا نیکرو
منظور شما در چه بخشی میباشد؟
قطبیت پیوند یا قطبیت ترکیب یا اختلاف الکترونگاتیوی؟