همواره تعدادی از دانش آموزان با نحوه ی چینش الکترونها در اتم مشکل دارند. در این شبیه ساز شما به راحتی می توانید مهارت خود را در زمینهی آرایش الکترونی هر عنصر تقویت نمایید. همچنین ساختار لایهای اتم مورد نظر خود را ببینید، ضمن اینکه با روند تناوبی تغییر شعاع اتمی در دوره های جدول تناوبی که در شیمی یازدهم اشاره شده هم آشنا شوید.
کمی با ترتیب پر شدن الکترونها در اطراف اتم آشنا شویم:
هر اتم به تعداد عدد اتمی خود هم پروتون [در هسته] و هم الکترون [پیرامون هسته خود] دارد. این الکترونها به طور تصادفی در اطراف هسته اتم قرار نمی گیرند، بلکه با نظمی خاص در لایه ها و زیر لایه های الکترونی قرار می گیرند.
درباره لایه ها و زیر لایه بیشتر بدانیم:
- در اطراف هسته ی اتم 7 لایه اصلی وجود دارد.
- هر لایه را با یک شماره و عدد نشان می دهند. این عدد را عدد کوانتومی اصلی می نامند و با نماد نمایش می دهند.
- هر لایه خود از چند تا زیر لایه تشکیل شده است که در هر لایه به تعداد شمارهی همان لایه، زیرلایه وجود دارد.
مثلأ: اگر باشد. یعنی لایهی چهارم، خود از 4 زیرلایه تشکیل شده است.
- هر زیر لایه را با عددی به نام عدد کوانتومی فرعی (اوربیتالی) نشان داده و با نماد نمایش می دهند:
- عدد کوانتومی می تواند از 0 تا تغییر کند؛ مثلا در لایهی چهارم ()، ۴ زیرلایه وجود دارد که اعداد آنها به ترتیب برابر با است.
- هر عدد مشخص کنندهی نوع زیر لایه است:
| زیر لایه | |
| زیر لایه | |
| زیر لایه | |
| زیر لایه | |
| زیر لایه | |
- هر زیر لایه واقع در هر لایه را با یک نمادی که از یک عدد و یک حرف تشکیل شده است، نمایش می دهند. عدد که همان است، مشخص کنندهی شمارهی لایه می باشد و حرف که همان هم ارز است، مشخص کننده ی نوع زیر لایه می باشد.
مثلا: زیرلایهی ، یعنی زیرلایه ای که در لایه ی سوم () بوده و عدد کوانتومی فرعی آن برابر با است.
| | مقادیر | تعداد زیر لایه | انواع زیر لایه |
| 1 | 0 | 1 | |
| 2 | 0,1 | 2 | |
| 3 | 0,1,2 | 3 | |
| 4 | 0,1,2,3 | 4 | |
| 5 | 0,1,2,3,4 | 5 | |
| 6 | 0,1,2,3,4,5 | 6 | |
| 7 | 0,1,2,3,4,5,6 | 7 | |
نکاتی در مورد عدد کوانتومی اصلی ():
- سطح انرژی لایه های الکترونی را نشان می دهد. (هرچه مقدار بیشتر باشد، انرژی لایه ها هم بیشتر است.)
- تعداد زیرلایه ها را در هر لایه نشان می دهد.(تعداد زیرلایه هر لایه=)
- می تواند مقادیر 1 تا 7 داشته باشد. (در اطراف هسته اتم حداکثر 7 لایهی الکترونی وجود دارد.)
- تعداد کل زیر لایه ها در هر لایه از رابطه ی بدست می آید.
نکاتی در مورد عدد کوانتومی فرعی ():
- دومین عدد کوانتومی نیز نامیده می شود.
- نوع زیرلایه را مشخص می کند.
- می تواند مقادیر صحیح از صفر تا را دربرگیرد.
ظرفیت الکترونی لایه ها و زیر لایه ها:
حداکثر ظرفیت الکترونی در هر لایه به تعداد الکترون است. مثلأ در لایه چهارم ()، حداکثر الکترون جای دارد.
حداکثر ظرفیت الکترونی در هر زیر لایه به تعداد است. مثلأ در زیرلایه () ، حداکثر الکترون جای می گیرد.
ترتیب پر شدن زیرلایه ها از الکترون (اصل آفبا)
اصل آفبا، ترتیب پر شدن زیر لایه های الکترونی در اتم را نشان می دهد. طبق این اصل وقتی الکترون به زیر لایه افزوده می شود، ابتدا زیر لایه نزدیک به هسته پر می شود که سطح انرژی کمتری دارد، در نهایت زیر لایه های بالاتر پر می شوند. طبق الگوریتم زیر:
نکته مهم: به دلیل پایین تر بودن سطح انرژی زیرلایهی نسبت به زیرلایهی ، به هنگام پرشدن زیرلایه ها، ابتدا زیرلایهی اشغال می شود و سپس زیرلایهی . این اتفاق در مورد زیرلایه های و بعدی هم می افتد، در مورد زیرلایهی و و نیز زیرلایه های و بعدی هم همین اتفاق می افتد.
منظور از زیر لایه نیمه پر وکاملا پر چیست؟
زمانی زیر لایه نیمه پر است یعنی دقیقا به تعداد نصف ظرفیت خود الکترون دارد و زمانی پر است که دقیقا به تعداد ظرفیت خود الکترون داشته باشد؛ بعنوان مثال در زیر لایه داریم:
- زمانی که نیمه پر است؛ یعنی هر ۵ زیرلایه ی به صورت تک الکترونی باشند:
| | | | | |
- زمانی که کاملأ پر است؛ یعنی هر ۵ زیرلایه ی به صورت جفت الکترونی باشند:
| | | | | |
بنابراین زمانی که این زیرلایه به صورت d۴ و یا d۹ باشد، از زیرلایه ی s ماقبلِ خود یک الکترون می گیرد و خودش به صورتd۵ و d۱۰ در آمده و زیرلایه ی s به صورت s۱ در خواهد آمد.
دقت کنید 4 عنصری که دارای آرایش الکترونی استثناء هستند عبارتند از:
آرایش عنصر Mo مانند Cr بوده، البته با یک لایه اضافه تر؛ یعنی این هر دو عنصر در یک گروه قرار دارند. دو عنصر Cu و Ag نیز مانند یکدیگرند.
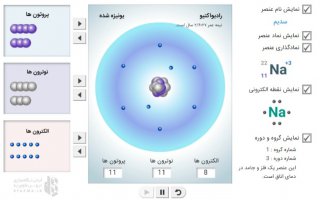
می دانیم مدل اتمی بور برای نمایش ساختار گونه هایی که تک اتمی هستند، کاربرد دارد و دانشمندان برای توجیه خواص سایر اتمها، ساختار لایهای ارائه دادند. بیرونی ترین لایهی اشغال شده توسط الکترون برای هر اتم، لایه ظرفیت نامیده می شود و تعداد الکترونها در این لایه رفتار شیمیایی هر اتم را توجیه می کند.
نحوه کار با شبیه ساز
قبل از کار با این شبیه ساز به شما توصیه می شود وارد شبیه ساز مربوط به بازی با عناصر جدول تناوبی شوید تا بهتر و بیشتر از این شبیه ساز بهره مند شوید.
با ورود به شبیه ساز، جدول تناوبی عناصر در اختیارتان قرار می گیرد. با کلیک روی هر عنصر از روی رنگ خانه، عنصر انتخابی، متوجه می شوید عنصر شما فلز، نافلز یا شبه فلز است. حتی اینکه فلز اصلی یا واسطه است نیز مشخص می باشد.
دسته عناصر گروه لانتانیدها واکتنیدها هم کاملا مشخص شده است.
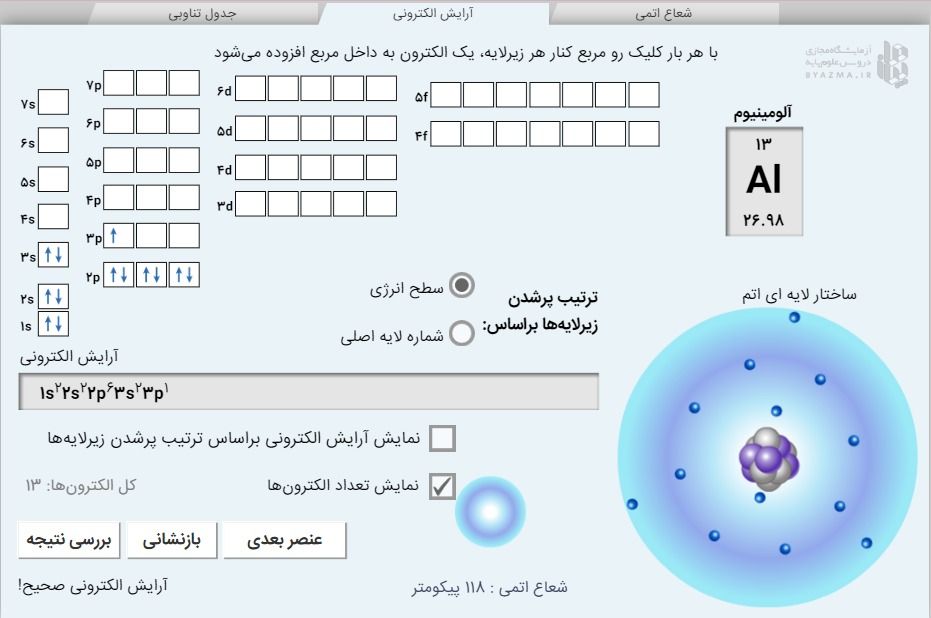
سپس در کادر بالای صفحه روی بخش آرایش الکترونی کلیک کنید تا صفحه مربوط برایتان باز شود. در این صفحه در قسمت راست و بالا، عنصر انتخابی شما نمایان می شود و عدد اتمیاش که نمایانگر تعداد پروتون های هسته و همچنین تعداد الکترون های اطراف هسته است کاملا واضح دیده می شود.
با کلیک بر روی ترتیب پر شدن الکترون ها بر اساس سطح انرژیِ زیر لایه ها طبق اصل آفبا برایتان مرتب می شوند. شما باید تعداد کل این الکترون ها را در زیر لایه ها بچینید. دقت کنید ابتدا در زیر لایه هایی که سطح انرزی یکسانی دارند مثل سه زیر لایه ، تنها یک الکترون قرار می گیرد و بعد از نیمه پر شدن زیر لایه مزبور، الکترون اضافی شروع به پر کردن زیر لایه (جفت شدن الکترون در مربع) می کند. با هر بار کلیک در مربع های کنار زیر لایه می توانید یک الکترون اضافه نمایید اما حواستان باشد برای هر اتم تنها به تعداد الکترونهایش، کلیک کنید تا با کمبود یا افزایش الکترون مواجه نشوید.
اگر الکترونها را دقیقا بر اساس اصل آفبا مرتب کنید با کلیک بر روی نمایش آرایش الکترونی بر اساس ترتیب پر شدن زیر لایه ها، آرایش الکترونی عنصر به ترتیبی که شما چینش کردید مشخص می شود. با کلیک بر روی بررسی نتیجه متوجه درست یا غلط بودن آرایش الکترونی عنصر مورد نظرتان می شوید. اگر آرایش الکترونی شما درست بود شعاع اتم برحسب یکای پیکومتر پایین صفحه نمایش داده می شود و در بخش ساختار لایهای اتم (سمت راست و پایین صفحه) متوجه تعداد الکترون های لایه ظرفیت اتم می شوید.
با کلیک بر روی بازنشانی تمام زیر لایه های شما خالی شده و دوباره می توانید از الکترون پر کنید. با کلیک بر روی عنصر بعدی می توانید عنصر جدیدی را انتخاب کرده و آرایش آن را رسم نمایید.
در ضمن با کلیک بر روی شعاع اتمی، شعاع عنصر بر حسب پیکومتر نمایش داده می شود و این مقدار روی نمودار صفحه بعد مشخص می شود. نمودار شعاع_عدداتمی را می توانید به بالا یا پایین، همچنین چپ و راست بکشید تا عدد اتمی و شعاع اتمی عنصر فرضی شما مشخص شود و با انتخاب چند عنصر که در یک دوره قرار دارند، نمودار "روند تغییر شعاع" در یک دوره را کامل درک کنید. در هر دوره از چپ به راست با افزایش عدد اتمی شعاع کاهش می یابد.
سوالات
۱- اصل آفبا را بیان کنید.
۲- زیر لایه حداکثر ظرفیت چند الکترون را دارد؟
۳- را برای زیر لایه مشخص کنید.
۴- آرایش الکترونی Mo را رسم کنید.
۵- آرایش الکترونی عنصری با ۳۳ الکترون را رسم نمایید. فلز و نافلز بودن آن را با توجه به ساختار لایهای آن مشخص نمایید.
۶- آرایش الکترونی عنصر شماره ۲۵ جدول را رسم نمایید. این عنصر فلز یا نافلز است؟
۷- نام عنصر Y چیست؟ کجای جدول قرار دارد؟ فلز است یا نافلز؟ اصلی است یا واسطه؟ آرایش الکترونی آن را رسم کنید.
۸- سطح انرژی زیر لایه های و را با دلیل مقایسه کنید.
۹- شعاع اتمی عنصر چند پیکومتر است؟
۱۰- شعاع اتمی عناصر دوره سوم را روی نمودار نمایش داده و بگویید بیشترین شعاع و کمترین شعاع در این دوره مربوط به کدام یک از عناصر می باشد؟
- آشنایی با عناصر جدول تناوبی
- تشخیص فلز، نافلز و شبه فلز از روی رنگ خانه ها در جدول
- آشنایی با لایه ها و زیر لایه های الکترونی
- شناخت سطح انرژی زیر لایه ها
- آشنایی با ترتیب پر شدن زیر لایه ها از الکترون (اصل آفبا)
- نوشتن درست و دقیق آرایش الکترونی عناصر
- درک فلز یا نافلز بودن عنصر با توجه به ساختار لایهای اتم
- مطالعه شعاع اتمی هر عنصر
- رسم نمودار تغییر شعاع اتم ها در یک دوره یا گروه جدول



عسل
۲۵ مهر ۱۴۰۴شهره امیرقلی
پس لایه اشغال شده یعنی لایهای که توسط الکترون پر شده
دینا سادات رخ صفت
۹ مهر ۱۴۰۲حدیثه مرادی
۷ مهر ۱۴۰۲