- در زمستان، مردم اغلب کیسه های بزرگ سنگ نمک تهیه می کنند تا روی مسیرهای پیاده رو بپاشند. چرا این کار را انجام می دهند؟
- نقطه انجماد آب خالص 0 درجه سانتیگراد (32 درجه فارنهایت) است. به نظر شما افزودن نمک به آب چه تاثیری بر نقطه انجماد آب دارد؟
مایع: حالتی که در آن ماده حجم مشخصی دارد اما شکل مشخصی ندارد یک مایع به شکل ظرف در می آید اما نمی تواند منبسط یا فشرده شود. مولکول های یک مایع به طور تصادفی حرکت می کنند اما نزدیک به یکدیگر می مانند.
جامد: فازی که در آن ماده شکل مشخص و حجم معین دارد. یک جامد همان شکل و حجم را در هر ظرفی حفظ می کند.
اتم ها در یک جامد در یک ساختار صلب نگه داشته می شوند و نمی توانند آزادانه حرکت کنند. آب در فاز جامد یخ نامیده می شود. در حالت جامد،مولکول ها در شبکه های بلوری در جای ثابت در حال ارتعاش هستند.
نقطه ذوب: دمایی که در آن ذوب اتفاق می افتد.
در سطح دریا، نقطه ذوب آب خالص 0 درجه سانتیگراد (32 درجه فارنهایت) است.
سرعت تبدیل: سرعتی که در آن مولکول ها از یک فاز به فاز دیگر، مانند از مایع به جامد یا جامد به مایع، انتقال می یابند.
اگر سرعت تبدیل مایع به جامد بیشتر از سرعت تبدیل جامد به مایع باشد، ماده یخ می زند.
اگر سرعت تبدیل جامد به مایع بیشتر از سرعت تبدیل مایع به جامد باشد، ماده ذوب می شود.
فرآیند تبدیل از مایع به جامد را انجماد می گویند.
نقطه انجماد: دمایی که در آن انجماد رخ می دهد.
در سطح دریا، نقطه انجماد آب خالص 0 درجه سانتیگراد (32 درجه فارنهایت) است.
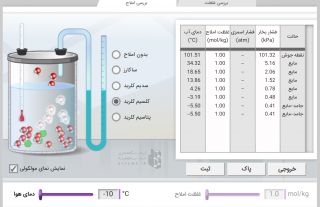
اثر ناخالصی در نقطه انجماد
ناخالصی باعث کاهش نقطه انجماد می شود. به عبارت دیگر، اضافه کردن یک ماده حل شونده غیر فرار به مایع، سبب کاهش آن خواهد شد. در این صورت، هر محلول آبی که دارای حل شونده غیر فرار باشد، در دمایی پایین تر از صفر درجه سانتیگراد منجمد می شود. به عنوان مثال محلول آب نمک نسبت به آب خالص، در دمای پایین تری منجمد می شود. در حقیقت از این خاصیت می توان در زمستان برای سرعت دادن به ذوب شدن یخ ها در خیابان ها، پیاده رو ها، جاده ها و یا سایر سطوح پوشیده از برف استفاده کرد.
کاهش نقطه انجماد از جمله خواص کولیگاتیو محسوب می شود و در واقع ناشی از اضافه شدن مولکول های حل شونده به حلال می باشد. همان طور که بیان شد، نقطه انجماد محلول ها به دلیل افزایش ناخالصی، پایین تر از نقطه انجماد حلال خالص خواهد بود. به بیان دیگر، این دما به طور مستقیم با غلظت مولال یا مولالیته حل شونده ارتباط دارد. در حقیقت هرچه مولالیته یک محلول بیشتر باشد، نزول نقطه انجماد آن نیز بیشتر بوده و در واقع دمای انجماد پایین تری خواهد داشت.
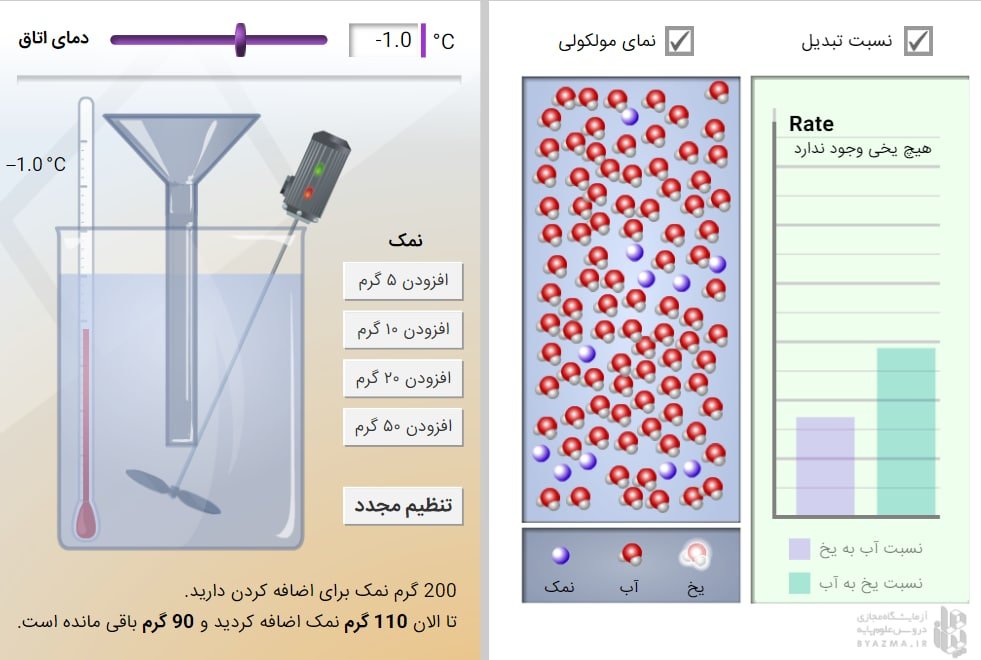
نحوه کار با شبیه ساز
دمای یک لیوان آب را کنترل کنید. با کاهش دما به زیر نقطه انجماد، تغییر حالت رخ می دهد که در سطح مولکولی قابل مشاهده است. نمک را می توان به آب اضافه کرد تا تاثیر آن را بر نقطه انجماد آب مشاهده کرد.
شبیه ساز دارای دو قسمت است در سمت چپ می توان میزان نمک اضافه شده به آب را تعیین کرد و دمای محلول را اندازه گرفت و در سمت راست با فعال کردن گزینه نسبت تغییر شکل: میزان و نسبت آب به یخ را قابل مشاهده است. و گزینه نمای مولکولی نوع ملکول ها و نحوه حرکت آن ها را نشان می دهد.
برای پیدا کردن دمای انجماد با اضافه کردن نمک به آب دما را پایین بیاورید (از قسمت تنظیم دما) و کم کم محلول داخل ظرف یخ می زند. که تغییرات و نحوه جنبش ملکول ها در نمودار سمت راست قابل مشاهده است و دمایی که دماسنج نشان می دهد در این زمان، دمای انجماد آب نمک است.
- آشنایی با نقطه ذوب
- آشنایی با نقطه انجماد
- مقایسه نقطه انجماد آب و محلول آب نمک
- مشاهده نحوه و میزان جنبش مولکول ها در حالت جامد و مایع


مجتبی اشرفی
۲۷ مهر ۱۴۰۴نسرین فرشادی
زمانی ذوب شدن یخ متوقف میشود که بتوانیم دما را تا ۵- کاهش دهیم و در این دما محلول مجدد شروع به یک زدن میکند (مگر اینکه ناخالصی بیشتری به محلول اضافه کنیم یا فشار هوا را تغییر دهیم.)
مهدیه
۱۶ فروردین ۱۴۰۴چه مایعاتی در فریزر یخ نمیزنند؟
نسرین فرشادی
برخی مایعات در فریزر به دلیل ویژگیهای خاص خود یخ نمیزنند یا یخ زدنشان بسیار دشوار است. مثل:
۱- الکل: الکل خالص بهسختی در دمای فریزر یخ میزنند، زیرا نقطهی انجماد آنها بسیار پایین است. مثلا نقطه انجماد اتانول(الکل صنعتی) حدود ۱۱۵- درجه سانتیگراد است.
۲- مایعات حاوی نمک زیاد: مثل آبنمکهای بسیار غلیظ که به دلیل کاهش نقطهی انجماد در دمای فریزر یخ نمیزنند یا به سختی یخ میزنند.
۳- روغنها: بیشتر روغنها مانند روغن زیتون در دمای معمول فریزر یخ نمیزنند.
............
۴ اسفند ۱۴۰۳نسرین فرشادی
ابوالفضل حسین علی زاده
۲۱ دی ۱۴۰۳نسرین فرشادی
در مورد دمای زنده باد که با نام دمای حسی هم شناخته میشود، دمایی است که به دلیل وزش باد به وجود میآید و در کوهنوردی بسیار مهم است. وزش باد باعث میشود محلول آب و نمک زودتر منجمد شده و نیازی به دمای خیلی پایین نداشته باشیم.
ابوالفضل حسین علی زاده
۲۱ دی ۱۴۰۳نسرین فرشادی
پیشنهاد میشود سوال را دقیقتر مطرح کنید تا بتوان بررسی کرد.
علی
۲۴ آذر ۱۴۰۳برای مثال یه دبه ۱۹ لیتری خیارشور ک ۷/۵ کیلو خیار داره و تقریبا ۱۰ لیتر اب ک در ان ۷۲۰ گرم نمک حل شده تقریبا در چه دمایی یخ میزند
نسرین فرشادی
این شبیه سازها آموزشی و مختص کتب درسی هستند، سوالات در این حوزه پاسخگو خواهیم بود.
نقطه انجماد آب نمک به عوامل مختلفی بستگی داشته و باتوجه به داده های شما نمیتوان دمای آن را مشخص کرد.
پیشنهاد میشود به طور عملی و از طریق آزمایش این دما را پیدا کنید.
ساجده
۲۴ آبان ۱۴۰۳علی کرمی
دلوین
۶ آبان ۱۴۰۳نسرین فرشادی
به طور کلی انحلال نمک در آب باعث کاهش دمای انجماد و افزایش دمای جوش میشود.
این پدیده به دلیل تغییر در فشار بخار آب و وجود ناخالصی میباشد.
ارش
۲۰ مهر ۱۴۰۳علی کرمی
آب شور بسته به درصد نمک حل شده میتواند دیرتر یخ بزند.
فاطمه
۱۳ مهر ۱۴۰۳علی کرمی
پس ابتدا باید مقدار آب، دمای اولیه آن و درصد نمک حل شده در آب را مشخص کنید تا بتوان با تقریب مناسبی زمان انجماد آب نمک را بدست آورد.
نیشتمان
۸ مهر ۱۴۰۳و اینکه ما فروسیانید پتاسیم رو وقتی به نمک می زنیم رنگش آبی میشه میشه دلیلش رو بفرمایید؟
علی کرمی
برای سوال اول، اطلاع نداریم که چه فعالیت هایی در این کارخانه ها انجام میشود. توجه داشته باشید که شبیهساز های بیازما آموزشی بوده و برای استفاده در محیط واقعی طراحی نشدهاند.
سوال دوم: وقتی فروسیانید پتاسیم به نمک اضافه شود ترکیب جدیدی به نام فروسیانید آهن(II) تشکیل میشود که این کمپلکس به رنگ آبی است.
حنانه
۷ مهر ۱۴۰۳( باروش علمی )
علی کرمی
در آب خالص، مولکولهای آب به راحتی میتوانند به هم متصل شده و بلورهای یخ را تشکیل دهند. اما با افزودن نمک باعث افزایش اختلال در ساختار مولکولی آب میشوند که [یون های سدم و کلر حاصل از نمک] مانع از نزدیک شدن مولکولهای آب به یکدیگر و تشکیل بلورهای یخ میشوند. (پس با افزایش غلظت نمک در آب، فعالیت مولکولی آب کاهش مییابد. این کاهش فعالیت به معنای کاهش توانایی مولکولهای آب برای تشکیل یخ است، به این ترتیب یخ در دمای پایین تری تشکیل میشود.)
سارا ملکی
نسرین فرشادی
سینا
۲۷ تیر ۱۴۰۳نسرین فرشادی
این شبیه سازها آموزشی ومختص کتب درسی هستند
سوالات در این حوزه پاسخگو خواهیم بود
ولی پور
۷ اسفند ۱۴۰۲نسرین فرشادی
،،،،،،،،،،
۱۰ بهمن ۱۴۰۲الف،۳گرم. ب،۵گرم
ج،۶گرم. د،۷گرم
نسرین فرشادی
۷گرم
مقدس
۱۸ دی ۱۴۰۲نسرین فرشادی
طاها احمدی
نسرین فرشادی
در واقع می توان از تفاوت نقطه انجماد آب شیرین و آب شور برای نمک زدایی استفاده کرد.
(برای مطالعه بیشتر می توانید به کتاب «چگونه روی کوه یخ زنده می مانید؟» نوشته اروین برچر مراجعه کنید.)
شایان
۹ دی ۱۴۰۱علی کرمی
شایان امینی
۹ دی ۱۴۰۱چند درصد از حجم آب باید نمک باشد تا در دمای ۱۰- یخ نزند
علی کرمی
۲۰ گرم نمک در ۱۰۰ سی سی آب