گاز کامل، گازی است که مولکول های آن فقط برخورد های صلب داشته و از قوانین ترمودینامیکی تبعیت می کنند.
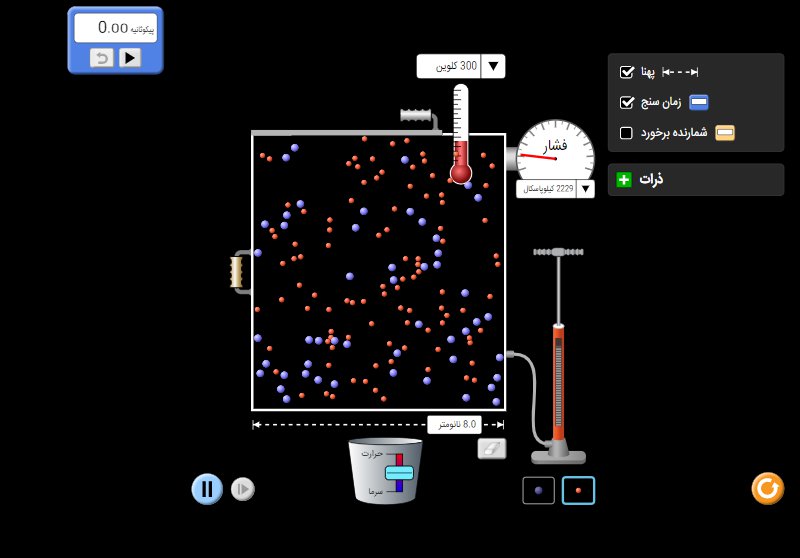
معادله حالت گاز های کامل به صورت بوده که می توان با تغییر یکی از متغیرهای مستقل مانند دما، حجم و تعداد مول های گازی تاثیر هر کدام را روی متغیر وابسته فشار مشاهده کرد.
بطور کلی با ثابت نگه داشتن تعداد مول های گازی 4 فرآیند ترمودینامیکی داریم:
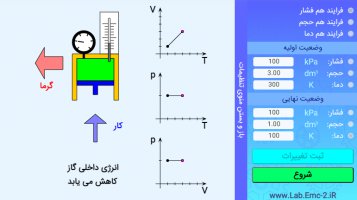
فرآیند هم حجم: حجم ثابت است، دما و فشار رابطه مستقیم باهم دارند.
فرآیند هم دما: دما ثابت، حجم و فشار رابطه عکس بایکدیگر دارند.
فرآیند هم فشار: فشار را ثابت نگه داشته، دما و حجم رابطه مستقیم دارند.
فرآیند بی دررو: هیچ متغییر ترمودینامیکی ثابت نبوده و گرمای سیستم صفر می باشد، در واقع سیستم را عایق می کنیم.
(البته فرآیند بی درو را در این آزمایش بررسی نمی کنیم.)
نحوه کار با شبیه ساز
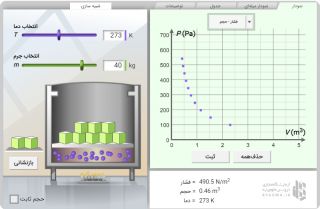
با آزمایش مقدماتی شروع کنید. مقداری گاز وارد سیستم کرده، دما یا حجم را تغییر دهید و تاثیر هریک را روی فشار مطالعه کنید.
سپس وارد آزمایش قوانین گازهای کامل شده و سعی کنید هر کدام از 3 فرآیندی که بالاتر معرفی کردیم( هم حجم، هم دما و هم فشار) انجام دهید و معادلات ترمودینامیکی هر حالت را بطور تجربی بدست آورید.
- آشنایی با یک سیستم ترمودینامیکی و عوامل موثر بر آن
- درک فرآیند های هم حجم، هم فشار و هم دما
- آشنایی با معادله حالت گاز های کامل
- مطالعه متغیرهای ترمودینامیکی مستقل و وابسته
- درک ارتباط بین متغیرهای ترمودینامیکی در هر کدام از فرآیند ها
- بدست آوردن روابط فرآیندهای ترمودینامیکی بطور تجربی