واکنش های شیمیایی گرماده انرژی آزاد می کنند، در حالی که واکنش های گرماگیر انرژی را جذب می کنند. اما چه چیزی باعث می شود که برخی از واکنش ها گرماده و برخی دیگر گرماگیر باشند؟ در این شبیه ساز، با مقایسه انرژی جذب شده در شکستن پیوندها و انرژی آزاد شده در تشکیل، مشخص شود که واکنش گرماده یا گرماگیر است.
آنتالپی یکی از پارامترهای مهم ترمودینامیکی است. Enthalpy را می توان یک تابع حالت از سیستم های ترمودینامیکی دانست که در ارتباط مستقیم با دما، فشار و حجم سیستم قرار دارد.
یکای اندازه گیری این کمیت مانند انرژی، ژول (J) است
و معرف میزان گرمای موجود در یک سیستم ترمودینامیکی تلقی کرد.
انرژی حرارتی به سادگی قابل اندازهگیری نیست. اما تغییر دمای حاصل از جریان انرژی حرارتی بین اشیا یا مواد، قابل اندازهگیری است. گرماسنجی یا کالریمتری شامل مجموعهای از روشهایی است که به منظور اندازهگیری تغییرات آنتالپی در یک فرآیند شیمیایی انجام میگیرد و اندازه گیری آن با کمک دستگاهی به نام گرماسنج یا کالریمتر انجام میشود.
مفاهیم کلیدی
گرماسنج (کالریمتر): دستگاهی که برای اندازه گیری مقدار انرژی گرمایی که از یک سیستم به سیستم دیگر منتقل شده استفاده می شود. بیشتر کالریسنجها ظروف عایقبندی خوبی هستند که با آب پر شدهاند. مقدار گرمای تولید شده با تغییر دمای آب اندازه گیری می شود.
پیوند شیمیایی: جاذبه ای بین اتم ها که منجر به تشکیل یک مولکول یا ترکیب می شود. پیوندهای شیمیایی شامل پیوندهای یونی، کووالانسی و فلزی است.
گرماگیر: فرآیندی که انرژی گرمایی را جذب می کند. در یک واکنش گرماگیر، دمای سیستم کاهش می یابد.
در یک واکنش گرماگیر، آنتالپی سیستم افزایش می یابد زیرا انرژی به سیستم جذب می شود.
آنتالپی: اندازه گیری انرژی موجود در یک سیستم
آنتالپی (H) برابر است با انرژی داخلی یک سیستم (U) به اضافه حاصل ضرب فشار و حجم سیستم:
در اکثر موارد، اندازه گیری مستقیم آنتالپی یک سیستم امکان پذیر نیست. با این حال، تغییرات در آنتالپی () را می توان با اندازه گیری تغییرات دما، فشار و حجم یافت
اگر یک سیستم گرما را جذب کند، آنتالپی آن افزایش می یابد.() اگر یک سیستم گرما ساطع کند، آنتالپی آن کاهش می یابد.()
گرماده: فرآیندی که انرژی گرمایی را آزاد می کند. در یک واکنش گرماده، دمای سیستم افزایش می یابد.
در یک واکنش گرماده، آنتالپی سیستم کاهش می یابد زیرا انرژی از سیستم ساطع می شود.
قانون هس: قانونی که بیان می کند که تغییر آنتالپی یک سیستم در طول یک واکنش شیمیایی مستقل از ترتیب مراحلی است که در آن واکنش انجام می شود. اگر یک تغییر شیمیایی می تواند به روش های مختلف اتفاق بیفتد، تغییر آنتالپی کل بدون توجه به دنباله ای که گرفته شود یکسان خواهد بود.
نحوه کار با شبیه ساز
درست مانند آهنرباها، اتم های عناصر مختلف با هم جذب می شوند تا پیوندهای شیمیایی تشکیل دهند. شکستن این پیوندها نیاز به انرژی دارد. هنگامی که یک پیوند جدید تشکیل می شود، انرژی آزاد می شود و دما افزایش می یابد. در انرژی واکنش، چگونگی ارتباط انرژی پیوند شیمیایی با تغییرات دمایی که در طی واکنش های شیمیایی رخ می دهد را بررسی خواهید کرد.
در این قسمت نحوه کار با واکنش1 توضیح داده شده است که بقیه واکنش ها نیز به همین ترتیب قابل بررسی و آزمایش هستند:
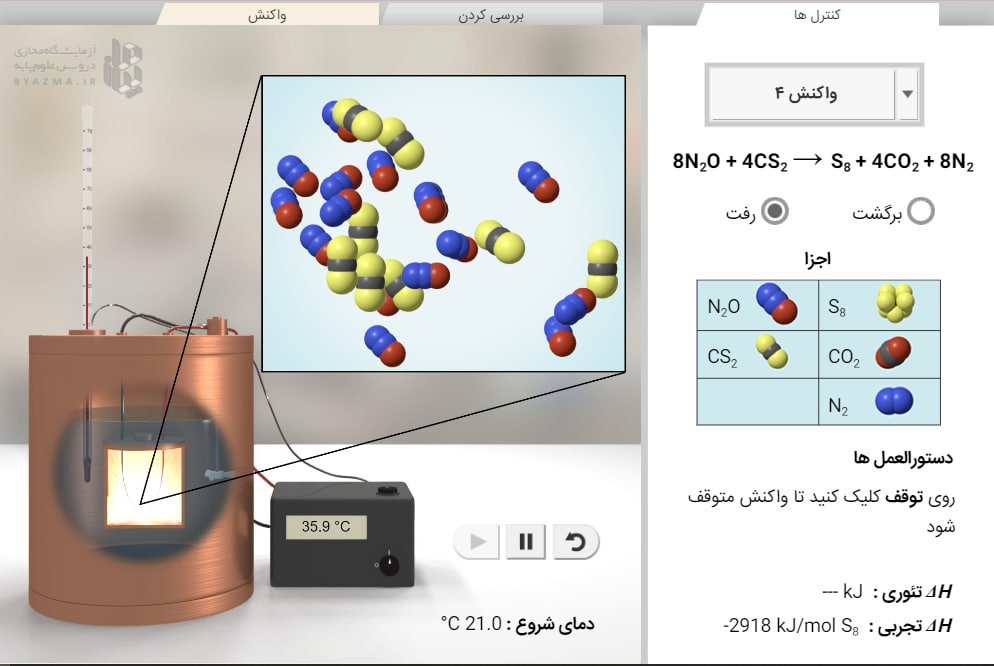
برای شروع، بررسی کنید که واکنش 1 و رفت انتخاب شده باشند. در این واکنش، هیدروژن (H2) و اکسیژن (O2) واکنش داده و آب (H2O) را تشکیل می دهند. این واکنش در داخل دستگاهی به نام کالریمتر انجام می شود. در داخل کالریمتر، یک محفظه کوچک واکنش دهنده ها را نگه می دارد. بقیه کالری سنج با آب پر می شود.
1. روی Play کلیک کنید. چه اتفاقی می افتد؟
2. دما چگونه تغییر می کند؟
ion is too long to be save
در شبیه ساز، انرژی مورد نیاز برای شکستن یک پیوند شیمیایی با قرار دادن یک مولکول در مجموعهای از پنجههای مکانیکی مدلسازی میشود. که می توان از قسمت "بررسی کردن" یکی از مولکول های هیدروژن (H2) را بین پنجه ها قرار دهید و گزینه شکستن پیوند را انتخاب کنید.
الف. چه اتفاقی می افتد؟
ب. به زیر ستون انرژی جذب شده جدول نگاه کنید. چقدر انرژی برای شکستن این پیوند لازم بود؟
توجه: انرژی در اینجا بر حسب واحد کیلوژول بر مول () است. این انرژی بر حسب کیلوژول است که برای شکستن تمام پیوندهای H-H در یک مول گاز H2 لازم است.
توجه: اتم های اکسیژن توسط یک پیوند کووالانسی دوگانه به هم متصل شده اند. این به این دلیل است که اتم های اکسیژن دو جفت الکترون مشترک دارند. مولکول اکسیژن را در پنجه ها قرار دهید و شکستن پیوند را فشار دهید.
الف. چه مقدار انرژی برای شکستن اولین پیوند O-O لازم است؟
ب. باند شکستن را فشار دهید. چقدر انرژی برای شکستن هر دو پیوند لازم است؟
ج- کل انرژی مورد نیاز برای شکستن دو مول مولکول H2 و یک مول مولکول O2 چقدر است؟
Translation is too long to be saved
فعالیت A:
دو اتم اکسیژن را از پنجه ها جدا کنید. حالا پنجه ها ناپدید می شوند و الگویی برای ایجاد یک مولکول آب می بینید. یک اکسیژن و یک اتم هیدروژن را به داخل الگو بکشید. (در صورت لزوم، از کلید سمت راست به عنوان مرجع استفاده کنید.)
الف)روی ایجاد پیوند کلیک کنید. چه اتفاقی می افتد؟
ب) گزینه شکست پیوند که می بینید نشان دهنده آزاد شدن انرژی جنبشی است که هنگام تشکیل یک پیوند رخ می دهد. چقدر انرژی آزاد شد؟
ج) مولکول هیدروژن دیگری را به داخل الگو بکشید و روی "تشکیل پیوند" کلیک کنید تا یک مولکول آب بسازید. کل انرژی آزاد شده تاکنون چقدر است؟
د) اولین مولکول آب را از قالب دور کنید، سپس از شبیه ساز برای ایجاد مولکول آب دوم استفاده کنید. در حال حاضر کل انرژی آزاد شده چقدر است؟
ه) محاسبه: انرژی جذب شده در شکستن مولکول ها را با انرژی آزاد شده هنگام تشکیل پیوندهای جدید مقایسه کنید.
- 1- در این واکنش انرژی بیشتری جذب شد یا آزاد شد؟
- 2- چه ارتباطی با تغییر دمای مشاهده شده برای این واکنش دارد؟
- 3- تغییر آنتالپی () سیستم برابر است با کل انرژی جذب شده منهای کل انرژی آزاد شده. مقدار برای این واکنش چقدر است؟ این مقدار را با ΔH نظری که در سمت راست فهرست شده است مقایسه کنید.
نتیجه گیری کنید: مقدار تجربی با اندازه گیری میزان گرمای تولید شده در واکنش در داخل کالریمتر تعیین شد. این بر اساس تغییر دمای واکنش، مقدار آب داخل کالریسنج و گرمای ویژه کالریسنج محاسبه میشود. تغییر نظری آنتالپی را با مقدار تجربی مقایسه کنید. آیا این مقادیر نزدیک هستند؟
فعالیت B:
جهت واکنش شبیه ساز را آماده کنید:
- تب واکنش را انتخاب کنید.
- با انتخاب واکنش1، برگشت را انتخاب کنید.
در یک واکنش گرماگیر، انرژی گرمایی بیشتری در شکستن پیوندها جذب می شود تا انرژی گرمایی که در تشکیل پیوند آزاد می شود. دما کاهش می یابد و آنتالپی افزایش می یابد.
سوال: چگونه می توان جهت یک واکنش شیمیایی را پیش بینی کرد؟
توجه کنید که در واکنش معکوس، ظرف با مولکول های آب پر می شود.
الف. روی گزینه پخش کلیک کنید. چه اتفاقی می افتد؟
ب. آیا دما تغییر کرد؟
ج. آیا شواهدی دال بر وقوع واکنش وجود دارد؟
بررسی: به تب بررسی کردن بروید. از پنجه ها برای شکستن دو مولکول آب استفاده کنید و سپس دو مولکول هیدروژن و یک مولکول اکسیژن تشکیل دهید.
الف- چه مقدار انرژی در شکستن مولکول های آب جذب شد؟
ب- چه مقدار انرژی در تشکیل مولکول های محصول آزاد شد؟
ج- تغییر کل آنتالپی در سیستم چقدر است؟
د- بر اساس این نتیجه، آیا این واکنش گرماده است یا گرماگیر؟
توضیح:
بیشتر واکنش های گرماگیر رخ نمی دهند مگر اینکه یک ورودی مداوم انرژی وجود داشته باشد. به عنوان مثال، مولکول های آب می توانند با افزودن نمک و عبور جریان الکتریکی از آب به گاز هیدروژن و اکسیژن تجزیه شوند.
واکنش هایی که انرژی گرمایی ساطع می کنند، واکنش های گرماده نامیده می شوند. در یک واکنش گرماده، انرژی گرمایی با تشکیل پیوندها بیشتر از انرژی گرمایی آزاد می شود که در شکستن پیوندها جذب می شود. در یک واکنش گرماده، دمای محیط اطراف افزایش می یابد و آنتالپی سیستم با ساطع شدن انرژی از سیستم کاهش می یابد.
در یک واکنش گرماگیر، انرژی گرمایی بیشتری در شکستن پیوندها جذب می شود تا انرژی گرمایی که در تشکیل پیوند آزاد می شود. دما کاهش می یابد و آنتالپی افزایش می یابد.
- آشنایی با مفهوم آنتالپی و گرمای واکنش
- مشاهده نحوه شکستن و تشکیل پیوند های شیمیایی
- بررسی و مقایسه میزان انرژی لازم برای تشکیل یا شکستن پیوند
- مقایسه آنتالپی تئوری و تجربی
- مشاهده نحوه کار کالیمتر
- آشنایی با قانون هس
- اندازه گیری تغییرات آنتالپی واکنش به صورت تئوری
- آشنایی با واکنش های گرماگیر و گرماده