سلام بیازماییها امیدوارم که حالتون خوب باشه. در این شبیه ساز قراره که طیف نشری خطی رو یاد بگیریم فقط قبلش باید یه سری مباحث مهم رو بهتون بگم.
میدونیم که در اطراف هسته اتم، ۷ تا لایه وجود داره (تا الان هفت تا لایه بوده حالا آینده چی بشه خدا داند).
به لایه، تراز یا مدار یا سطح انرژی هم میگن.
هر الکترونی در تراز خاصی قرار میگیره. مثلا اتم هیدروژن کلا یک الکترون داره که اون الکترون در لایه اول قرار میگیره که این لایه برای الکترونِ هیدروژن میشه تراز پایهاش. اگه به الکترونی یک مقدار انرژی مشخص بدیم، از تراز خودش که بهش میگیم تراز پایه، به ترازهای بالاتر میره که به اصطلاح میگیم که اون الکترون برانگیخته شده یا مُلتَهِب شده.
نکته۱: اگر انرژی داده شده به اتم، از یک حدی بیشتر باشه حتی میتونه باعث کنده شده الکترون از اون اتم بشه و اتم رو تبدیل به یون کنه.
نکته۲: این انرژیای که به الکترون میدیم تا از لایه خودش به لایه بالاتر بره، باید به اندازه فاصله اون دو لایه یا اون دو تراز باشه (به زبون خودمون الکترون باید بنزین داشته باشه که این راه رو بتونه طی کنه)؛ مثلا اگه الکترون رو بخوایم از لایه دوم به سوم بفرستیم، باید به اندازه فاصله این دو لایه بهش انرژی بدیم.
حالا بریم ادامه بحث...
وقتی الکترون در تراز خودش باشه آرامش داره و آرومه اما وقتی که برانگیخته میشه دیگه اون آرامش اولیه رو نداره برای همین دوست داره که اون انرژیای که گرفته و برانگیخته شده رو از دست بده و به خونه اصلی خودش که تراز پایه خودش هست برگرده. کل طبیعت دوست داره که آروم و پایدار باشه نه فقط الکترونها و کلا طول عمر تراز برانگیخته بسیار کوتاه هستش پس الکترونها تمایل دارن هرچی سریعتر انرژیای که گرفتن رو از دست بدن و دوباره پایدار بشن.
وقتی الکترون به تراز خودش برمیگرده اون انرژیای که گرفته بود و برانگیخته شده بود رو به شکل امواج الکترومغناطیس پس میده.
یادآوری: امواج الکترومغناطیس، انواع مختلفی داره مثل امواج فروسرخ، نور مرئی، امواج فرابنفش و ...
چند تا نکته مهم:
الف) هر الکترون، یک حالت پایه بیشتر نداره اما میتونه چندتا حالت برانگیخته داشته باشه مثلا لایه اول، حالت پایه الکترونِ اتمِ هیدروژنه اما لایههای دوم تا هفتم، لایههای برانگیخته برای این الکترون هستن.
ب) انرژی و طول موج، رابطه عکس دارن. هرچی تفاوت فاصله بین دو لايه یا دو ترازی که الکترون قراره طی کنه بیشتر باشه، پس انرژی بیشتری هم باید بگیره یا پس بده چون راه طولانیتره. پس هر چی انرژی بیشتر باشه، طول موج مربوط به انتقال اون مسیر، كوتاهتر میشه.
سوال چالشی: تراز پایه برای الکترون شماره شش از اتم نیتروژن کدام تراز است؟
خب حالا طیف خطی نشری چیه؟
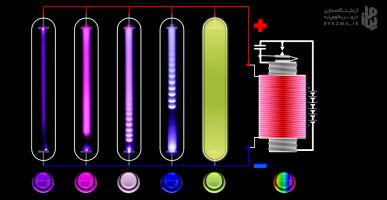
اگه مادهای در فاز گازی (یا در حالت گازی) باشه و به اون ماده انرژی داده بشه، الکترونهای اون گاز، برانگیخته (یا ملتهب) میشن؛ وقتی این الکترونها به تراز پایه خودشون برگردن، از خودشون میتونن نور ساطع کنن (تابش کنن) یعنی اون انرژیای که گرفتن و رفتن به لایههای بالا رو به شکل نور پس میدن (که نور هم موج الکترومغناطیس هستش). اگر این نورهای ساطع شده رو از منشور عبور بدیم، طیف نشری خطی مشاهده میشه یعنی منشور نور رو تجزیه میکنه و به خطهایی تقسیم میکنه که همون طیف نشری خطی هستش. هر خط یک طول موج خاص رو نشون میده. طیفی نشری خطی هیچ دو عنصری مشابه هم نیست و هر عنصری طیف نشری خطی مخصوص به خودش رو داره (مثل اثر انگشت) که از این ویژگی برای شناسایی عنصرها استفاده میشه. به طیف نشری خطی، طیف گسیلی ناپیوسته یا طیف اتمی هم میگن.
بیشتر بدانید۱: اگه بخوایم علمیتر صحبت کنیم، وقتی الکترونها به تراز پایه خودشون برگردن، از خودشون میتونن فُوتُون تابش کنن (ساطع کنن) یعنی اون انرژیای که گرفتن و رفتن به لایههای بالا رو به شکل فُوتُون پس میدن. فُوتُونها، بستههای بسیار ریز انرژیان؛ فوتونها ذراتی بدون جرم و بار هستن و ذراتی هستن که بر موج سوار هستن، در اصل امواج الکترومغناطیس از فوُتوُن تشکیل شده یعنی فُوتُونها، کوچکترین واحد تقسیم ناپذیر نور هستن.
بیشتر بدانید۲: اصلا بعضی عنصرها مثل هلیوم، تالیم و سزیم با روشهای طیفسنجی شناسایی و کشف شدن.
بیشتر بدانید۳: نیلز بور کسی بود که با مطالعه طیف نشری خطی هیدروژن مهمترین نظریه اتمی را در مورد ساختار اتم ارائه داد.
بیشتر بدانید۴: گفتیم که در طیف نشری خطی، به یک مادهای انرژی میدیم و الکترونهاش ملتهب میشن، روشهایی برای برانگیختن اتم یا مولکولهای مواد در طیف نشری خطی وجود داره:
- آ) نمکها رو بیشتر در معرض شعله قرار می دن (طیف شعله).
- ب) مواد گازی را تخلیه الکتریکی میکنن (طیف تخلیه).
- پ) فلزات و مواد جامد را گرما میدن تا ملتهب بشن (طیف جسم ملتهب).
- ت) فلزات قلیایی ( فلزات گروه اول جدول) و قلیایی خاکی (فلزات گروه دوم جدول) رو در مجاورت گرمای حاصل از کمان الکتریکی قرار میدن (طیف جرقه).
نحوه کار با شبیه ساز
برای شروع کلیک کنید.
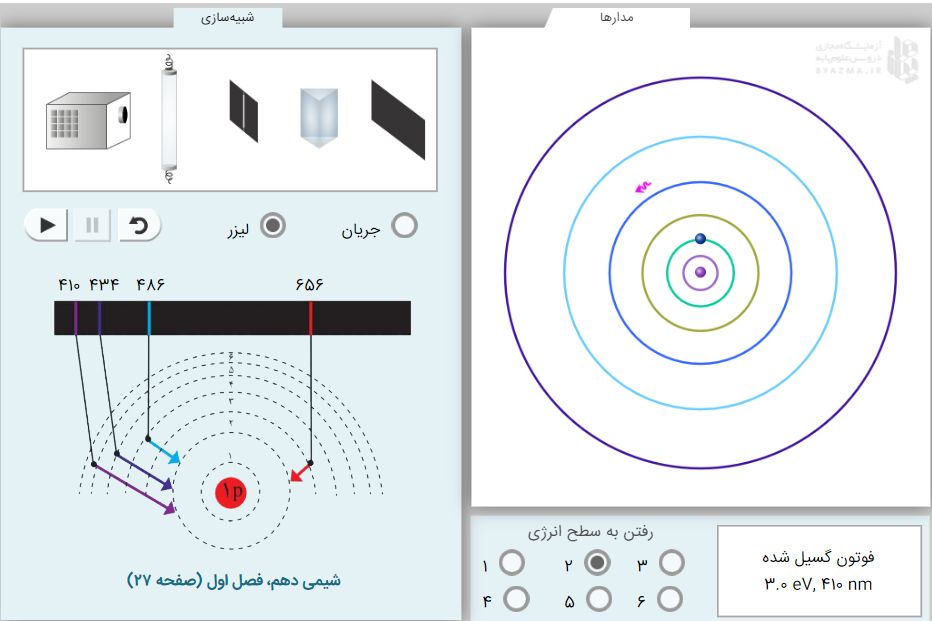
در سمت چپ شبیه ساز در بخش مدارها، لایههای الکترونی برای شما نمایش داده شده. در سمت راست، اتمای میبینین که در اطراف هسته خودش، شش تا لایه یا تراز الکترونی یا سطح انرژیاش رو گذاشتن و در تراز اول، فقط یک الکترون داره پس این اتم هیدروژنه (البته میتون یونای باشه که یک الکترون داره مثلا لیتیم دوبار مثبت)!
در پایینِ ترازها، نوشته شده رفتن به سطح انرژی و شش تا شماره براتون گذاشته شده.
بیایید با هم شروع کنیم و از سطح انرژی ۱ به ۲ بریم. وقتی شماره ۲ رو بزنید، الکترونای که در سطح انرژی ۱ هست، مقداری انرژی میگیره و به سطح ۲ میره. دوباره وقتی عدد ۱ رو بزنید، همین الکترون که در سطح انرژی ۲ قرار داره، به سطح انرژی ۱ برمیگرده در پایین صفحه، در کادر خالی کنار اون شمارهها، مقدار انرژیای که لازمه تا الکترون از دست بده و از تراز یا سطح انرژی شماره ۲ به ۱ برگرده رو نشون میده؛ همچنین، طول موج مربوط به این انتقال رو هم مینویسه یعنی بهمون میگه که اون انرژیای الکترون پس داده، نوعی موج بوده و طول این موج چقدره!
توجه۱: وقتی الکترون از سطح انرژی بالاتر به سطح انرژی پایین تر برمیگرده مقداری انرژی تابش یا گسیل میکنه (یعنی انرژی پس میده) که ممکنه این انرژی رو به شکلهای مختلفی پس بده مثل: امواج فرابنفش، نور مرئی، امواج فروسرخ و ...
مثلا برای اتم هیدروژن وقتی با شبیه ساز ۲ به ۱ رو بزنید، یک فلش خاکستری آزاد میشه که یعنی در برگشت الکترون از تراز ۲ به ۱ مقداری انرژی فرابنفش آزاد میشه که چون نور فرابنفش برای ما قابل دیدن نیست، فلش، خاکستری میشه.
نکته۳: انرژی، واحدهای مختلف داره که یکی از اون واحدها، الکترون وُلت هستش که با نماد eV نشون میدن.پس اون eV جلوی انرژی، واحدش رو نشون میده.
نکته۴: طول، واحدهای مختلف داره که یکی از اون واحدها، نانومتر هستش که با نماد nm نشون میدن.پس اون nm جلوی طول موج، واحدش رو نشون میده.
حالا عدد شماره ۳ رو بزنید، الکترونای که در سطح انرژی ۲ بود، مقداری انرژی میگیره و به سطح ۳ میره. دوباره در پایین صفحه، در کادر خالی کنار اون شمارهها، مقدار انرژیای که لازمه تا الکترون از تراز یا سطح انرژی شماره ۲ به ۳ بره و طول موج مربوط به این انتقال رو نشون میده.
سوال چالشی: انرژی برای انتقال ۲ به ۱ از ۳ به ۲ بیشتر بود نه؟!!
علتش اینه که در واقعیت، فاصله لایه ۱ تا ۲ از لایه ۲ تا ۳ بیشتره و الکترون برای جابهجایی باید راه بیشتری طی کنه. هرچی از هسته دور میشیم فاصله لایهها کمتر میشه.
سوال چالشی: چرا طول موج انتقال ۱ به ۲ از ۲ به ۳ کمتره؟!!
علتش اینه که در واقعیت، فاصله لایه ۱ تا ۲ از لایه ۲ تا ۳ بیشتره و الکترون برای جابهجایی باید راه بیشتری طی کنه و این یعنی انرژی بیشتر؛ از طرفی انرژی با طول موج رابطه عکس داره یعنی هرچی انرژی بیشتر، طول موج کوتاهتر (مثل یه فنر فشرده که انرژی بیشتری تو خودش جمع کرده).
حالا بریم سراغ شیمی دهم صفحه ۲۷....
آقای بالمِر اومد کشف کرد که اگه الکترون هیدروژن از لایههای دیگه به سطح انرژی دوم برگرده، از خودش نوری تابش میکنه که برای ما قابل دیدنه یعنی در اتم هیدروژن، بازگشت الکترون به تراز دوم، در ناحیه مرئی میافته. که به سِری بالمر مشهور شده.
حالا از شبیه ساز ببینید که وقتی الکترون از لایههای بالاتر به سطح ۲ (لایه ۲) بیاد، باعث میشه چه رنگی در طیف خطی ظاهر بشه.
از قسمت پایین صفحه (در سمت راست شبیه ساز) از شماره ۳ برید به ۲ و به جابهجایی الکترون در لایهها دقت کنید، میبینید:
- وقتی الکترون از لایه ۳ به ۲ میره یه نور کوچولو قرمز پس میده (به شکل یه فلش کوچولو) که طول موج این انتقال ۶۵۶ نانومتر هستش. این انتقال در سری بالمر، چون انرژی کمی الکترون باید پس بده تا از ۳ به ۲ بیاد، پس طول موج بیشتر نسبت به بقیه داره.
- وقتی الکترون از ۴ به ۲ میره یه نور کوچولو آبی پس میده که طول موج این انتقال ۴۸۶ نانومتر هستش.
- وقتی الکترون از ۵ به ۲ میره یه نور کوچولو نیلی پس میده که طول موج این انتقال ۴۳۴ نانومتر هستش.
- وقتی الکترون از ۶ به ۲ میره یه نور کوچولو بنفش پس میده که طول موج این انتقال ۴۱۰ نانومتر هستش. این انتقال در سری بالمر، چون انرژی زیادی الکترون باید پس بده. تا از ۶ به ۲ بیاد، پس طول موج کمتر نسبت به بقیه داره.
توجه۲: با یه مقایسه کوچیک میتونید ببینید که طول موج انتقال ۳ به ۲ از ۶ به ۲ بیشتره چون ۳ به ۲ مسیر کمتری از ۶ به ۲ هستش و انرژی کمتری الکترون باید پس بده تا از ۳ بیاد به سمت ۲ و هرچی انرژی کمتر، طول موج بیشتر.
حالا به سمت راست شبیه ساز نگاه کنید، عکس کتاب دقیقا برای شما گذاشته شده، به اون نوار مشکی که چهار تا خطی رنگی داره دقت کنید. به اون نوار میگن طیف نشری خطی اتم هیدروژن (این همه گفتیم که به این برسیم فقط?)
حالا دیگه خودتون میتونید متوجه بشید اون خطهای رنگی روی نوار چیه (امیدوارم...).
برای بار هزارم:)
- طیف بنفش: انتقال ۶ به ۲
- طیف نیلی: انتقال ۵ به ۲
- طیف آبی: انتقال ۴ به ۲
- طیف قرمز: انقال ۳ به ۲
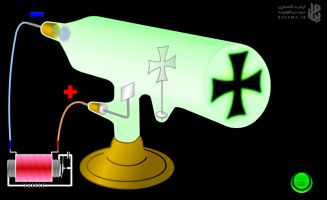
حالا به قسمت چپ شبیه ساز اون بالا نگاه کنید، تیک جریان رو فعال کنید. این بخش، شبیه سازی از تحقیقات علمی در دنیای واقعی نشون میده که چطوری به هیدروژن، انرژی میتابونَن.
خب همونطوری که میبینید (بالای شبیه ساز، سمت راست)، با یک منبع جریان ولتاژ زیادی به یک لوله (که بهش میگن لامپ تخلیه الکتریکی) بدیم، الکترونهای اتمهای هیدروژن داخل لامپ، برانگیخته میشن و میرن به لایههای بالاتر و موقع برگشت به تراز پایه، نور نشر میکنن (نور پس میدن). این نور از یک شکاف عبور میکنه و با عبور از منشور تفکیک میشه و توسط آشکارساز به صورت خطهایی روی صفحه عکاسی ظاهر میشه. این خطها بعضیاشون خط رنگی هستن که الان میدونید چرا رنگیان. (برای هیدروژن اون انتقالهایی که الکترون به لایه یا تراز 2 برگشته، خط رنگی میده).
توجه۳: خطوطی که به ترازهای دیگه غیر از ۲ برگشته باشن رنگ ندارن برای همینه که بیشتر نوار، تیره هستش!
حالا همزمان که تیک جریان رو فعال کردید، به مدارها هم دقت کنید که مثل یک فیلم انتقالهای الکترون رو داره نشون میده.
سوال:طول موج مربوط به انتقال ۵ به ۲ و ۴ به ۲ را مقایسه کنید.
سوال:چرا انتقال الکترونی ۳ به ۴ از ۵ به ۶، انرژی بیشتری میخواهد؟
- آشنایی با طیف نشری خطی هیدروژن
- معرفی تراز پایه و برانگیخته
- ایجاد ارتباط بین فواصل لایهها و انرژی
- ایجاد ارتباط بین فواصل لایهها و طول موج
- بررسی نحوه انتقالات الکترونی در اتم هیدروژن
- تدریس صفحه 27 از کتاب شیمی دهم با نکات کامل




k.r
۲۷ دی ۱۴۰۴یک سوال،اگر تنها الکترون اتم هیدروژن در لایه دوم قرار داشته باشد اتم هیدروژن در حالت پایه قرا دارد یا برانگیخته؟!
نیکا نیکرو
دقت کنید لایههای الکترونی در هر اتم لزوما نباید ۶ یا ۷ مورد باشد بلکه باتوجه به تعداد الکترون آن اتم، تعدادی لایه تشکیل میشود پس باتوجه به هیدروژن که یک الکترون دارد، فقط یک لایه الکترونی خواهد داشت.
تک الکترون اتم هیدروژن برای اینکه به لایههای دیگر برود باید برانگیخته شود پس اگر الکترون در لایه دوم باشد حتما برانگیخته است.
ریحانه
۱۴ دی ۱۴۰۴نیکا نیکرو
برای اتم هیدروژن با الکترون در لایه ششم، همهی انتقالهای بازگشتی بین لایههای ۶ تا ۱ ممکناند. تعداد کل انتقالهای ممکن برابر است این فرمول:
n × (n-1) ÷ 2
که اگر n=6 باشد جواب میشود:
6 × 5 ÷ 2 = 15
میتوان این را بهصورت احتمالهای بازگشت الکترون هم نوشت:
از شش به پنج
از شش به چهار
از شش به سه
از شش به دو
از شش به یک
از پنج به چهار
از پنج به سه
از پنج به دو
از پنج به یک
از چهار به سه
از چهار به دو
از چهار به یک
از سه به دو
از سه به یک
از دو به یک
پس کلا ۱۵ بازگشت ممکن است.
افرا
۴ دی ۱۴۰۴و رنگاشونو از کجا بدونیم
نیکا نیکرو
وقتی الکترون، انرژی دریافت میکند و به تراز بالاتر میرود این انتقال جذب است زیرا با گرفتن انرژی همراه بوده است و به ترازهای بالاتر رفتهاند.
و وقتی الکترون از لایههای بالاتر به پایین برمیگردد انرژی از دست میدهد یا همان نشر میکند.
برای هر اتم، بازگشت به لایه خاصی در ناحیه مرئی (قابل دیدن با چشم انسان) میافتد؛ مثلا برای اتم هیدروژن وقتی الکترون به لایه دوم برمیگردد ما میتوانیم انرژی نشر شده را به شکل نور مرئی ببینیم.
برای اینکه بدانیم هر کدام چه رنگی دارد از طیف نشری خطی کمک میگیریم که نواری با زمینه مشکی و دارای خطوط رنگی است که این خطوط رنگی همان انتقالهایی هستند که الکترون به ناحیه مرئی برگشته است.
Ana
۴ آذر ۱۴۰۴میشه لطفا بگید کدوم انتقال ها فرابنفش هستند و کدوم فروسرخ و طول موجشون چه طوری میشه ؟
نیکا نیکرو
انتقال از لایههای بالاتر به لایه اول (n=1) در محدوده فرابنفشه، به لایه دوم (n=2) محدوده مرئی و انتقال به لایههای سوم و بالاتر (..و n=3,4,5) در محدوده فروسرخ قرار میگیره
طول موج فرابنفش از همه کمتره (پرانرژیتر) و طول موج فروسرخ از همه بیشتر (کمانرژیتر)
کارن
۷ آبان ۱۴۰۴ببخشید طبق شکل صفحه ۲۷ کتاب شیمی دهم چگونه در اتم هیدروژن وقتی الکترون از لایه های ۶ ۵ ۴ ۳ همه ی این ها به لایه ۲ می اید وطیف نشرخطی که به۴ رنگ میباشد چطور همزمان الکترون از این ۴لایه به لایه دو می ایند و همزمان رنگ نورشان پدید می اید و یک الکترون کار ۴الکترون رو انجام می دهد مثلا الکترون از لایه ۶ به ۲ می اید و همزمان نیز رنگ منتشر شده از لایه ۵ به ۲ نیز می اید که همه همرمان است
نیکا نیکرو
اگر درست متوجه سوال شما شده باشم باید بگم که هر جهش فقط بین دو سطح انرژی هستش مثلاً:
- یک الکترون از n=6 به n=2 میپرد: نور بنفش تولید میشود.
- دیگری از n=5 به n=2: نور آبی-نیلی.
- دیگری از n=4 به n=2: نور آبی.
- دیگری از n=3 به n=2: نور قرمز.
اینها چهار جهش مستقل هستند که ممکن است توسط الکترونهای مختلف یا در زمانهای مختلف انجام شوند. اما چون تعداد زیادی اتم هیدروژن در لولهی تخلیه وجود دارد، این جهشها تقریباً همزمان رخ میدهند و ما همهی رنگها را با هم میبینیم.
امید
۲ مهر ۱۴۰۴وقت بخیر.. یه سوال از خدمت شما
برای اتم سدیم میتونیم بگیم که تعداد حالت های پایه موجود برای الکترونها ۳ تا هست؟ حالت پایه لایه اول مختص الکترونهای همون لایه .. حالت پایه لایه دوم مختص الکترونهای همون لایه دوم و حالت پایه لایه سوم هم مختص همون الکترونهای موجود در لایه سوم ..
هیدروژن فقط یک حالت پایه برای الکترون خودش داره و حالت پایه اول برای همه اتمها مشترک هست و همه اتمها حداقل یک حالت پایه را دارند ؟
نیکا نیکرو
✅ بله، میتوان گفت که در حالت پایه، الکترونهای سدیم در سه لایه اصلی قرار دارند و هر لایه حالت پایه خاص خود را دارد. اما توجه کنید که حالت پایه کل اتم فقط یکی است یعنی: در مکانیک کوانتومی، حالت پایه (ground state) به کل سیستم اشاره دارد، نه به هر لایه جداگانه. پس اگر بگوییم "سدیم سه حالت پایه دارد"، از نظر علمی دقیق نیست. بهتر است که بگوییم: «در حالت پایه، الکترونهای سدیم در سه لایه اصلی توزیع شدهاند.»
اتم هیدروژن، فقط یک حالت پایه دارد که همان 1s است. بنابراین درست است که همه اتمها حداقل یک حالت پایه دارند، اما برای تعریف حالت پایه کل اتم به آنچه که در بالاتر اشاره شد دقت کنید.
امید
۳۱ مرداد ۱۴۰۴و اینکه ممکنه از لایه پنجم بره لایه چهارم و دیگه پایین نیاد و تو همون لایه چهارم گیر کنه
کلا برای انتقال الکترونی از لایه مثلا ۵ به لایه ۲ چند تا پرتو ممکنه نشر بشه ؟
نیکا نیکرو
در رابطه با اینکه پرسیدید آیا الکترون میتونه مرحله به مرحله پایین بیاد باید بگم که: بله، کاملاً ممکنه. وقتی الکترونای در یک اتم در حالت برانگیخته قرار میگیره (مثلاً در لایه پنجم)، میتونه به صورت مرحلهای به لایههای پایینتر برگرده. در هر مرحله، اختلاف انرژی بین دو لایه به صورت فوتون (پرتو الکترومغناطیسی) آزاد میشه.
و در رابطه با سوال دوم، آیا ممکنه الکترون در یک لایه (مثلاً چهارم) گیر کنه و پایینتر نیاد؟ باید بگم که: در شرایط خاص، بله. اگر الکترون به لایهای برسه که پایداری نسبی داشته باشه (مثلاً حالت شبهپایدار یا متاستابل) یا محیط اطراف اجازهی نشر فوتون نده (مثلاً در محیطهای خاصی مثل لیزرها یا گازهای رقیق) ممکنه الکترون برای مدتی طولانی در اون سطح باقی بمونه. این حالتها در طراحی لیزرها و طیفسنجی بسیار مهماند.
و اما سوال سوم: برای انتقال از لایه ۵ به لایه ۲ چند فوتون ممکنه نشر بشه؟ این بستگی به مسیر انتقال داره. چند حالت ممکنه: یک دفعه از پنج بیاد دو یا اینکه مرحله به مرحله از پنج بیاد دو یا ترکیبی عمل کنه مثلا یکبار از پنج بیاد سه و سپس از سه بیاد دو!
در واقع، هر مسیر مجاز کوانتومی که اختلاف انرژیها رو پوشش بده، میتونه رخ بده. طیفهای نشری اتمها دقیقاً از همین مسیرهای مختلف ناشی میشن.
نارا
۵ فروردین ۱۴۰۴نیکا نیکرو
حتما دارید با خودتون میگید که چرا انتقال ۶ به ۲ قابل مشاهدهاس اما ۷ به ۲ نه! باید بگم که
انتقال از n=7 به n=2 انرژی بیشتری آزاد میکند که معمولاً در ناحیه فرابنفش قرار میگیرد و برای چشم انسان قابل رؤیت نیست.
بنابراین، دلیل اینکه انتقال از n=6 به n=2 قابل مشاهده است، این است که انرژی تابش در محدوده نور مرئی قرار دارد، در حالی که انتقال از n=7 به n=2 در ناحیه فرابنفش قرار میگیرد و قابل مشاهده نیست.
س
۲۳ بهمن ۱۴۰۳یک سوال دارم چرا الکترون در بازگشت به لایه های دیگه رنگی رو ایجاد نمیکنه
نیکا نیکرو
در طیف نشری خطی هیدروژن، بازگشت الکترون به لایه شماره دوم، در محدوده مرئی قرار میگیره که برای چشم انسان قابل مشاهده است. وقتی الکترون به لایههای دیگه برمیگرده باز هم موج الکترومغناطیس ساطع میکنه اما در محدوده بینایی انسان نیست. ممکنه که تعدادی از موجودات این انتقالات هم بتونن مشاهده کنن اما انسان فقط محدوده مرئی رو میتونه ببینه.
Nazi
۲۳ دی ۱۴۰۳نیکا نیکرو
فاصله بین نوارها در طیف نشری خطی، اختلاف بین سطحهای انرژی مختلف را در اتم نشان میدهد. هرچه بین نوارها فاصله بیشتری وجود داشته باشد، اختلاف انرژی بین سطوح انرژی هم بیشتر است؛ یعنی زمانی که الکترون از سطح انرژی بالاتر به سطح انرژی پایینتر برمیگردد، مقدار انرژی بیشتری آزاد میکند. به زبان ساده اینکه، در انتقالی که راه بیشتری طی شده باشد، آن انتقال انرژی بیشتری دارد
برای سوال شما باید تراز فرودی را مشخص کنیم اما به طور کلی تراز ۶ به ۱ بیشترین انرژی را خواهد داشت.
Helen
۱۷ دی ۱۴۰۳نیکا نیکرو
بله طیف نشری خطی هر عنصر، به ساختار آن، تعداد الکترونها(عدد اتمی) و... بستگی دارد. (ساختار الکترونی هر اتم هم متفاوت است.)
Alina
۱۴ دی ۱۴۰۳نیکا نیکرو
افزایش طول موج یعنی انرژی کمتر و انرژی کمتر یعنی الکترون فاصله کمتری را پیموده است مثلا بازگشت الکترون از تراز ۳ به ۲، نسبت به ۴ به ۲، فاصله کمتری محسوب میشود.
برای طول موج ۳ به ۲ که طول موج بالا با انرژی کم محسوب میشود، رنگ مرتبط این انتقال در طیف نشری خطی هیدروژن، قرمز میباشد.
در کل هر چه طول موج بیشتر شود، انرژی کمتر و فاصله بین لایههایی که الکترون منتقل شده است هم کمتر بوده است.
ساجده
۸ دی ۱۴۰۳نیکا نیکرو
پریا
۸ دی ۱۴۰۳جذب انرژی n=1بهn=3بیشتره یا n=2به n=5?
نیکا نیکرو
کوثر
۵ آذر ۱۴۰۳نیکا نیکرو
برای این اتفاق چند تا عامل وجود داره مثلا:
- الکترونهای برانگیخته ممکنه با ذرات دیگه مثل فوتونها (بستههای انرژی)، الکترونهای دیگه یا حتی مولکولهای اطراف خود برخورد کنن که این تعاملات میتونه باعث بشه که الکترونها انرژی خودشون رو از دست بدن و به حالت پایه برنگردن.
- الکترونهای برانگیخته میتونن انرژی خودشون رو به محیط اطراف انتقال بدن، مثلاً از طریق تابش گرما یا تابش الکترومغناطیسی، در نتیجه به حالت پایه نیان.
حنانه
۱۴ آبان ۱۴۰۳چرا خطوط طیفی نشری هیدروژن به تراز ۲ میباشد نه یک؟
نیکا نیکرو
برای اتم هیدروژن، بازگشت الکترون از ترازهای بالاتر به تراز اول هم اتفاق میافتد چون تراز اول، تراز پایه برای الکترون هیدروژن است اما چون انرژیای که الکترون به هنگام بازگشت به تراز اول آزاد میکند در ناحیه مرئی نمیافتد، ما نمیتوانیم آن انرژی را به شکل نور نشر شده رنگی و نوار رنگی در طیف نشری خطی ببینیم.
ستایش جمالی
۱۱ آبان ۱۴۰۳اگر طول موج بازگشت الکترون از لایه ۴به۳ برابر ۴۸۶nm باشد طول موج الکترون از لایه ۳به۲ می تواند حدود ۴۳۲nm باشد
آیا این درسته؟
نیکا نیکرو
در یک اتم هرچه از هسته اتم دورتر میشویم فاصله لایهها از هم کمتر میشود درنتیجه فاصله لایه ۳ به ۲ از ۴ به ۳ بیشتر است. هرچه فاصله لایهها بیشتر باشد، مسافتی که الکترون طی میکند هم بیشتر میشود پس انرژی بیشتر میشود. انرژی با طول موج رابطه عکس دارد پس در نتیجه طول موج کمتر خواهد شد پس با این تحلیل، این جمله میتواند درست باشد.
m
۱۰ آبان ۱۴۰۳نیکا نیکرو
بیشتر شدن طول موج یعنی انرژی کمتر و انرژی کمتر یعنی الکترون فاصله کمتری را پیموده است مثلا بازگشت الکترون از تراز ۳ به ۲، نسبت به ۴ به ۲، فاصله کمتری محسوب میشود. اگر الکترون در هنگام بازگشت، به تراز ۲ برگردد میتوانیم انرژی آزاد شده را به صورت طیف رنگی ببینیم و برای طول موج ۳ به ۲ که طول موج بالا با انرژی کم محسوب میشود، رنگ مرتبط این انتقال در طیف نشری خطی هیدروژن، قرمز میباشد. در کل هر چه طول موج بیشتر شود، انرژی کمتر و فاصله بین لایههایی که الکترون منتقل شده است هم کمتر بوده است.
R
۱۵ شهریور ۱۴۰۳نیکا نیکرو
بله، فاصله بین نوارها در طیف نشری خطی، اختلاف بین سطحهای انرژی مختلف را در اتم نشان میدهد. هرچه بین نوارها فاصله بیشتری وجود داشته باشد، اختلاف انرژی بین سطوح انرژی هم بیشتر است؛ یعنی زمانی که الکترون از سطح انرژی بالاتر به سطح انرژی پایینتر برمیگردد، مقدار انرژی بیشتری آزاد میکند.
Mch
۱۸ فروردین ۱۴۰۳چرا شدت خط های طیف گسیلی اتم هیدروژن با تم متفاوت است
نیکا نیکرو
Sadra82
۱۰ دی ۱۴۰۲نیکا نیکرو