طیف نشری
استفاده از خطوط نشری برای شناسایی اتم ها از مدت ها قبل در شیمی متداول بود، اما منشأ این خطوط بعدها و در اوایل قرن بیستم شناسایی شد. چه اتفاقی در داخل اتم باعث بوجود آمدن این رنگ های زیبا می شود؟
طیف نشری خطی
این طیف از تابش توسط بخار بسیار رقیق عنصرها شکل میگیرد. اگر این نور از منشور گذرانده شود، مشاهده میگردد که این طیف پیوسته نیست و تنها از چند خط رنگی جدا از هم با طول موجهای معین تشکیل شده است.
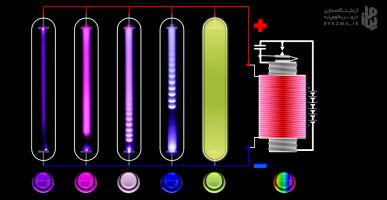
طیف نور گسیل شده از بخار هر عنصر را طیف اتمی آن عنصر مینامند. طیف اتمی حاصل از نور گسیل شده از بخار عنصرها را طیف نشری آن اتم مینامند. این نوع طیف از بخارهای عناصر در دمای زیاد و فشار کم و همچنین گازها تشکیل میشود. طیف نشری خطی هر عنصر در گستره مرئی، منحصر به فرد بوده و دارای نوارهای رنگی ویژه ای است. جایگاه هر نوار رنگی با طول موج آن مشخص می شود. از خطوط مشخصه در طیف های اتمی می توان برای شناسایی اتم ها استفاده کرد، درست مانند اثر انگشت که برای شناسایی انسان ها به کار می رود.
یکی از موفقیتهای اصلی مدل اتمی بور، توضیح طیف نشری خطی هیدروژن بود. پیش از مدل بور، به صورت تجربی کشف شده بود که اتم هیدروژن از خود نور نشر میدهد. حتی برای یافتن طول موج نور منتشر شده، فرمولی هم وجود داشت که البته آن هم به صورت تجربی به دست آمده بود.
مشکل اصلی توضیح علت انتشار نور و به وجود آمدن طیف نشری خطی بود که نیلز بور با ارائه مدل اتمی خود، به خوبی این پدیده را توضیح داد.
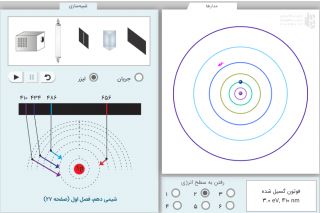
مدل اتمی بور بسیار شبیه به منظومهی شمسی است. در منظومهی شمسی یک ستاره (خورشید) در مرکز قرار دارد و تعدادی سیاره به دور آن گردش میکنند. در مدل بور هم هسته اتم (پروتونها و نوترونها) در مرکز قرار دارند و الکترونها در اطراف هسته در حال گردش هستند منتها در مدل بور، الکترونها نمیتوانند در هر مکانی قرار بگیرند. مکان الکترون به میزان انرژی آن بستگی دارد. هر چه الکترون انرژی بیشتری داشته باشد، در فاصله دورتری از هسته قرار میگیرد. انرژی الکترون محدود به مقادیر گسسته ثابتی است که اصطلاحا گفته میشود انرژی کوانتیزه است. یعنی به صورت بسته بسته است. نصف یک بسته نداریم و الکترون تنها میتواند بین این مقادیر گسسته انرژی تغییر مکان بدهد.
به همین صورت، مدارهایی که الکترون میتواند در آنها بچرخد هم در مکانهای ثابتی قرار دارند. یعنی چندین مدار وجود دارد که الکترون با توجه به انرژیاش در آنها قرار میگیرد و نمیتواند در فضایی بین این مدارها گردش کند.
کمترین سطح انرژی را حالت پایه میگویند. سطوح بعدی به ترتیب سطح برانگیخته اول، سطح برانگیخته دوم و …. نام دارند.
هیدروژن و لیتیم از اولین عناصری بودند که طیف نشری آنها به دست آمد. البته هیدروژن باید به صورت تک اتمی باشد تا این طیف را ایجاد کند. هیدروژن مولکولی طیف پیچیدهتری دارد.
در نهایت به انرژی یونش میرسیم. در این سطح از انرژی، الکترون از اتم جدا میشود و دیگر تحت تأثیر جاذبه هسته نیست. پس از این سطح، دیگر انرژی الکترون به صورت کوانتیزه نیست.
طیف نشری عناصر چگونه ایجاد میشود؟
تا اینجا صحبت از افزایش انرژی و رفتن الکترون به مدارهای بالاتر بود، اما اگر الکترون از یک مدار بالاتر به مدار پایینتر بیاید چه میشود؟
در مدار پایینتر، الکترون نمیتواند به همان اندازه که در مدار بالاتر انرژی داشته، انرژی داشته باشد. از طرفی، طبق قانون پایستگی انرژی، انرژی الکترون نمیتواند به خودی خود از بین برود. در نتیجه، الکترون انرژی اضافی خود را به صورت فوتون نور آزاد میکند. انرژی فوتون و طول موج آن به اختلاف انرژی دو مدار الکترونی بستگی دارد. هر چه اختلاف انرژی بیشتر باشد، انرژی فوتون هم بیشتر و طول موج آن کوتاهتر میشود.(طول موج و انرژی موج رابطه عکس دارند.)
در بسیاری از پدیدهها این اثر را میتوانیم ببینیم، از جمله وقتی که نمک خوراکی را در آتش میپاشیم و رنگ شعله زرد میشود. صحنههای زیبایی هم که در آتشبازی به وجود میآیند حاصل همین پدیده هستند.
نکته جالب اینجاست که هر عنصر، طیف نشری ویژه خودش را دارد. مثلا هر ترکیبی که دارای مس باشد، رنگ شعله را سبز و هر ترکیبی که دارای لیتیم باشد، رنگ شعله را سرخ میکند.
هر چه الکترون به مدارهای پایینتری سقوط کند، انرژی فوتون آزاد شده بیشتر است و طول موج آن پایینتر خواهد بود. مثلاً در اتم هیدروژن، اگر الکترون به لایه اول سقوط کند، نور منتشر شده فرابنفش خواهد بود. (با چشم ما قابل رویت نیست.) به طور کلی در اتم هیدروژن، هر گونه انتقال الکترون از لایههای بیشتر از دو، به لایه دوم تولید نور مرئی میکند. (چشم ما قادربه رویت طول موج های حدود ۴۰۰تا ۷۰۰ نانومتر است)
انتقال از لایههای بالاتر به لایه سوم، امواج فروسرخ ایجاد میکند .(باز نمی توانیم ببینیم)
بنابراین با توجه به رنگ شعله میتوان عنصر را تشخیص داد. البته دانشمندان با استفاده از دستگاهی به نام اسپکتروگراف، طیف نشری عنصر را تجزیه میکنند تا دقیقتر آن را بررسی نمایند.
دل هر ذره را که بشکافی آفتابیش در میان بینی
جلوه ای از هنر وزیبایی در نشرنور
یک روش جهت ایجاد تابش نور توسط عنصرها، استفاده از لامپ هایی است که حاوی بخار بسیار رقیق عنصر مربوطه است. در این لامپ ها عنصر مربوطه به دلیل جذب انرژی، ملتهب شده وشروع به تابش نور می کند. وجود عنصرهای مختلف در لامپ ها، باعث ایجاد رنگ های متفاوتی می شود. به عبارت دیگر نور لامپ هر عنصر با عنصر دیگر فرق می کند.
اسپکتروگراف یا طیفسنج چگونه کار میکند؟
نور سفید ترکیبی از امواج الکترومغناطیس با طول موج های مختلف میباشند. مثلاً وقتی نور سفید را میبینیم، در واقع ترکیبی از تمام طول موج های نور مرئی است.
وظیفه اسپکتروگراف اینست که طول موج های مختلف یک دسته از امواج الکترومغناطیسی را از هم تفکیک کند. در این دستگاه ابتدا نوری که از منبع تابانده میشود، از یک شکاف باریک عبور میکند و سپس باریکه نور به یک صفحه پراش تابانده میشود. صفحه پراش چیزی شبیه به روی، دی وی دی است. اگر دقت کرده باشید، سطح دی وی دی، نور را تجزیه میکند و چیزی شبیه به رنگین کمان روی آن دیده میشود. البته از منشور هم میتوان استفاده کرد.(در شبیه ساز ما از منشور استفاده شده)
سپس طیف نور تجزیه شده دوباره به سمت یک شکاف تابانده میشود تا فقط طیف نور مورد نظر جدا گردد. البته میتوان شکاف دوم را حذف کرد تا کل طیف به حسگر برخورد کند.
سادهترین نوع حسگر، یک کاغذ عکاسی است. این کاغذ در صورت تابانده شدن نور، تغییر رنگ میدهد. بسیاری از کشفیات اولیه با استفاده از همین حسگر انجام شد. اما امروزه از حسگرهای دیجیتال استفاده میشود که قادرند شدت نور را هم تشخیص دهند.
انواع طیف نوری
تا کنون فقط به بررسی طیف نشری پرداخته شد اما دو نوع طیف دیگر هم وجود دارد: طیف جذبی و طیف پیوسته
طیف نشری دارای پس زمینه سیاه است و خطوط رنگی بر روی آن دیده میشود. طیف جذبی دارای پسزمینه رنگی است و خطوط سیاه بر روی آن مشخص است.
طیف نشری زمانی ایجاد میشود که عنصر حرارت دیده و تنها منبع گرمای اطراف آن خودش است. در نتیجه فقط نوری که از خودش ساطع میشود وجود دارد. این نور پس از گذشتن از منشور یا صفحه پراش، به طول موجهای مختلف شکسته میشود.
علت فاصله بین نوارهای رنگی اینست که زاویه شکست برای هر طول موج متفاوت است و هر طول موج جایگاه خاص خودش را دارد. طیف جذبی زمانی ایجاد میشود که نور ساطع شده از عنصر، از یک منبع گرما عبور کند و در نتیجه بخشهای خاصی از طیف نور، چگالی کمتری داشته و نوارهای مشکی را ایجاد میکنند.
طیفسنجی
همانگونه که عنوان شد، یک طیف به بازهای از طول موجها گفته میشود. با عبور دادن نور از داخل منشور میتوان آن را به بخشهایی با طیفهای مشخص تقسیم کرد. اگرچه این روش بسیار مبتدیانه، اما کارآمد است.
به روش فوق، طیف سنجی یا «اسپکتروسکوپی» (Spectroscopy) گفته میشود.
کاربردهای طیف اتمی
طیف اتمی کاربردهای عملی بسیاری دارد. در حقیقت با توجه به اینکه طول موج نشر برای هر عنصر متفاوت است، بنابراین این ویژگی همچون اثر انگشت برای اتمها عمل میکند. برخی از اتمها با استفاده از تحلیل طیف اتمی کشف شدند. برای نمونه دانشمندان با مادهای جدید برخوردند که طیف اتمی متفاوتی داشت. آنها با استفاده از تحلیل طیف اتمی متوجه شدند با مادهای جدید روبرو شدند. بعدها این عنصر هلیوم نامگذاری شد. همچنین ستارهشناسان با استفاده از مفهوم طیفی اتمی میتوانند جنس اجرام دوردست را پیشبینی کنند.
طیف نشری هیدروژن در ستارهشناسی و نجوم اهمیت زیادی دارد زیرا بیشتر هستی از هیدروژن تشکیل شده است و با بررسی طیف نشری میتوانند اطلاعات بسیار زیادی از مکانهای دوردست کیهان به دست آورند.
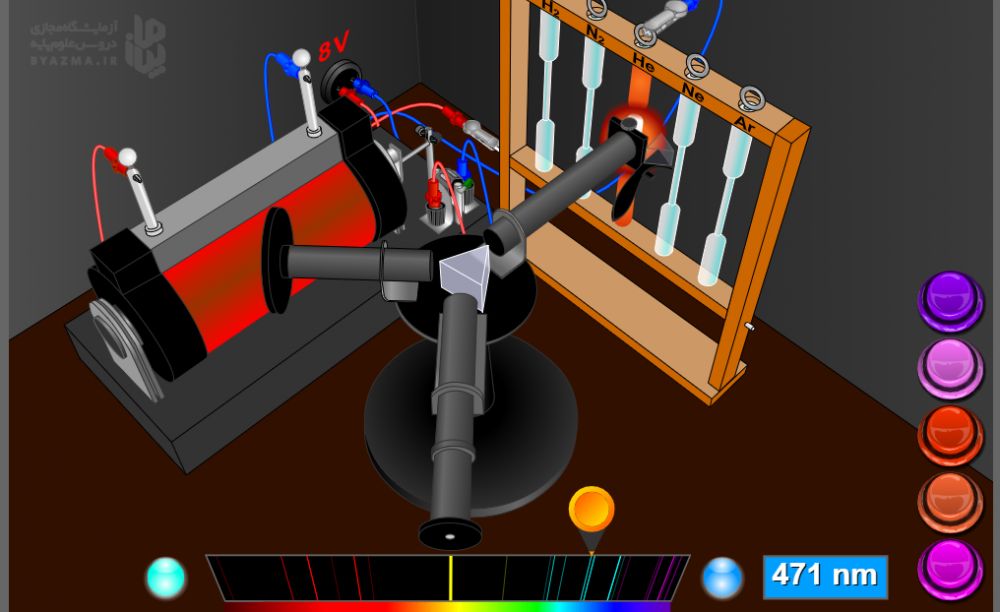
نحوه کار با شبیه ساز
شبیه ساز دستگاه اسپکتروگراف یا طیف سنج نوری می تواند طیف نشری خطی چند عنصر گازی (H2-N2-He-Ne-Ar) را نشان می دهد. شما می توانید روی هر کدام از دکمه های سمت راست کلیک کنید و طیف نشری خطی آن عنصر را مشاهده کنید. دو دکمه در سمت راست و چپ طیف قرار داد با کلیک روی آن ها، طول موج هر خط به همراه رنگ آن دیده می شود. طیف های هر عنصر را ببینید وبا هم مقایسه کنید.
سوالات
۱- چرا مدل اتمی بور نمی تواند ساختار اتم های بیش از یک الکترون را توجیه کند؟
۲- طیف نشری خطی چگونه ایجاد می شود؟
۳- دلیل اهمیت طیف های نشری چیست؟
۴- چرا طیف نشری خطی هر عنصر متفاوت است؟
۵- طول موج های خطوط در طیف نشری خطی هیدروژن چند نانومتر هستند؟
۶- چرا تعدادخطوط در طیف نشری خطی آرگون بیشتر از هیدروژن است؟
- آشنایی با نور بعنوان یک طیف الکترومغناطیس
- درک رابطه طول موج با انرژی موج
- آشنایی با اطلاعاتی که از نور بدست می آید
- مطالعه طیف نشری خطی عناصر بعنوان عامل شناسایی عناصر
- آشنایی با اساس کار دستگاه اسپکتروگراف (طیف سنج)
- درك دانش آموزان از دخالت علم شیمی در زندگی روزمره