واکنشهای برگشت پذیر:
واکنشهایی هستند که در آنها ضمن اینکه واکنش دهنده ها به فرآورده ها تبدیل شده، فرآورده ها هم به واکنش دهنده ها تبدیل میشن. بین واکنش دهنده و فرآورده علامت فلش دوطرفه قرار میدیم.
این واکنش ها زمانی به تعادل میرسن که سرعت واکنش رفت و برگشت در آن ها برابره. در زمان تعادل، با گذشت زمان غلظت واکنش دهنده ها و فرآورده ها دیگه تغییر نمی کنه ولی واکنش پویا است. یعنی سرعت واکنش رفت وبرگشت صفر نیست پس تغییراتی در خواص ظاهری دیده نمیشه. در لحظه تعادل برای هر واکنش تعادلی میشه ثابت تعادل را این چنین تعریف کرد:
به عنوان مثال: برای واکنش کلی گازی() یا محلولی()
عبارت ثابت تعادل به صورت زیر نوشته میشه:
در عبارت ثابت تعادل از نوشتن واکنش دهنده ها یا فرآورده هایی که حالت جامد() یا مایع() دارن صرف نظر می کنیم و فقط غلظت گازها() و محلول() را می نویسیم، چون غلظت مواد جامد و مایع خالص همیشه ثابته. در رابطه ثابت تعادل() حتما حتما باید غلظت ها در حالت تعادل را بنویسیم. یکای غلظت مولی ( مول بر لیتر یا ) است.
بعد از برقراری تعادل اگر از بیرون تغییری در واکنش بوجود بیاریم، مثلا فشار را کم یا زیاد کنیم، یا غلظت یکی از مواد شرکت کننده در واکنش را تغییر بدیم.
طبق اصل لوشاتلیه واکنش تعادلی به سمتی پیش میره که تغییر بوجود اومده را از بین ببره. در این شبیه ساز به بررسی اثر فشار بر روی چند واکنش تعادلی می پردازیم.
اثر تغییر حجم (تغییر فشار):
در دمای ثابت، در یک واکنش تعادلی که همه مواد به صورت گازند، کاهش حجم (افزایش فشار) تعادل را در جهت تولید تعداد مول های گازی کمتر جابجا می کنه تا زمانی که تعادل جدید برقرار بشه. بر اثر افزایش فشار(کاهش حجم)، غلظت تمام گونههای شرکت کننده در تعادل افزایش پیدا می کنه، در نتیجه سرعت واکنشهای رفت و برگشت در تعادل جدید هم افزایش پیدا میکنه.
دقیقا در دمای ثابت، در یک واکنش تعادلی که همه مواد به صورت گازند، افزایش حجم (کاهش فشار) تعادل را در جهت تولید مول های گازی بیشتر جابجا می کنه تا زمانی که تعادل جدیدی برقرار بشه. بر اثر کاهش فشار(افزایش حجم)، غلظت تمام گونههای گازی شرکت کننده در تعادل کاهش پیدا می کنه، در نتیجه سرعت واکنش های رفت و برگشت در تعادل جدید کاهش پیدا میکنه.
با تغییر حجم یا فشار، مقدار ثابت تعادل تغییر نمی کنه چون ثابت تعادل() فقط تابع دماست.
دقت کنید تغییر حجم(تغییر فشار) فقط تعادل هایی را می تونه جابجا کنه که دو شرط رو داشته باشند:
- ۱-حداقل یکی از مواد شرکت کننده، گاز باشه.
- ۲-شمار (تعداد) مول های گازی دو طرف معادله واکنش با هم برابر نباشه.
مواد جامد یا مایع خالص تراکم ناپذیرند بنابراین با تغییر حجم ظرف، غلظت آنها تغییری نمیکنه. تغییر فشار، تأثیری روی تعادلهایی که فقط مواد جامد یا مایع یا محلول دارند، نداره. همچنین در تعادل هایی که تعداد مول گازی دو طرف برابر باشه، تغییر فشار تأثیری بر جابجایی تعادل نداره اما غلظت مواد گازی می تونه کاهش یا افزایش پیدا کنه.
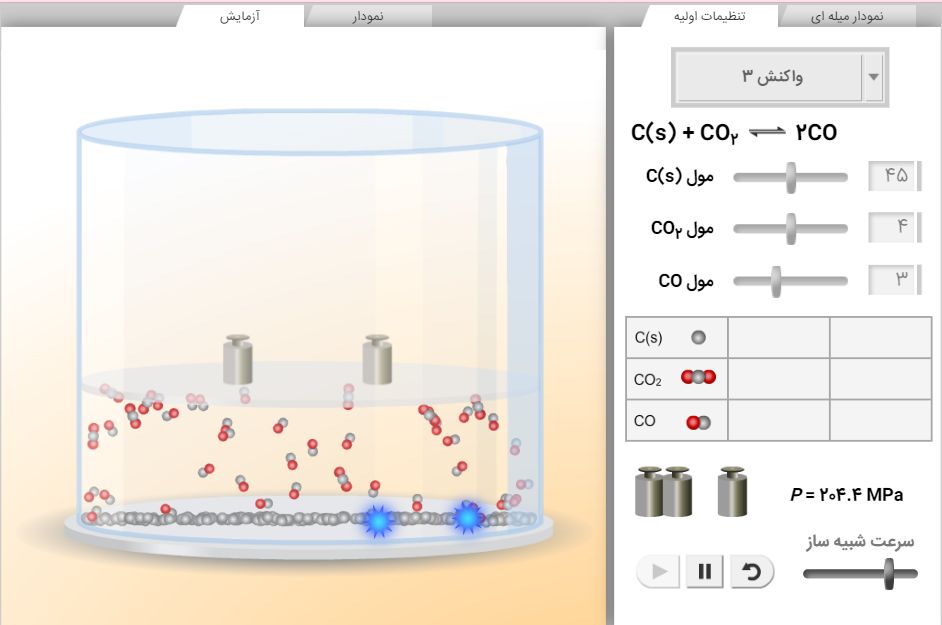
نحوه کار با شبیه ساز
با ورود به شبیه ساز از قسمت بالا روی تنظیمات اولیه کلیک کنید و یه واکنش به دلخواه خودتون انتخاب کنید. می تونید در همان بخش تنظیمات اولیه تعداد مول مواد واکنش دهنده و فرآورده را هم تنظیم کنید. تنظیم سرعت شبیه ساز هم به سلیقه شماست. بعد روی قسمت آزمایش کلیک کنید، انیمیشن واکنش براتون ظاهر میشه، روی قسمت نمودار کلیک کنید.
نرم افزار نمودار غلظت-زمان، مول-زمان، فشار-زمان و حتی نمودار لگاریتم غلظت-زمان و فشار-زمان واکنش منتخب شما را در شبیه ساز رسم می کنه. می تونید روی قسمت نمودار میلهای هم کلیک کنید و در هر لحظه تغییرات مول، غلظت و فشار را ببینید.
با کمک اعداد غلظت واکنش دهنده و فرآورده ثابت تعادل واکنش مورد نظرتون رو محاسبه کنید.
حالا وزنه هایی که تو صفحه می بینید را بکشید و روی پیستون در قسمت آزمایش رها کنید. جالبه با قرار دادن وزنه ها یعنی شما به واکنش از بیرون فشار اعمال کردید و حجم ظرف واکنش کم میشه. تعادل بهم میخوره و طبق اصل لوشاتلیه واکنش به سمت تعداد مول گازی کمتر جابه جا میشه. این اصل را با کلیک کردن رو قسمت نمودار غلظت-زمان و همین طور قسمت نمودار میلهای و تغییر کردن غلظت و مول مواد شرکت کننده در واکنش می بینید. وقتی به تعادل جدید رسیدید، اعداد غلظت تعادلی را یادداشت کرده و ثابت تعادل جدید را محاسبه کنید. اگر خطایی نداشته باشید متوجه می شوید که ثابت تعادل همان عدد قبلی است.
سوالات:
۱- در واکنش اول تعدادمول NO2 را ۸ و تعدادمول N2O4 را صفر در نظر گرفته و آزمایش را تکرار کنید. نمودار مول-زمان را چطور توجیه می کنید؟
۲- ثابت تعادل واکنش را محاسبه کنید.
۳-سه تا وزنه را با درگ کردن بکشید روی پیستون واکنش رها کنید. حالا چه تغییری در نمودار مول-زمان دیده می شود؟
۴- با توجه به اعداد جدید غلظت که از بخش نمودار میلهای دریافت می کنید. ثابت تعادل جدید را محاسبه کنید.
۵- با مقایسه دو ثابت تعادلی که بدست آوردید چه نتیجه ای می گیرید؟
۶- با توجه به اصل لوشاتلیه تغییرات بوجود آمده را توجیه کنید.
7- برای هریک از واکنش های زیر، رابطه ثابت تعادل را نوشته و یکای آن را مشخص کنید:
1)
2)
3)
4)
- آشنایی با واکنشهای برگشت پذیر و تعادلی
- آشنایی با ثابت تعادل
- فراگیری اصل لوشاتلیه
- بررسی عوامل موثر بر تعادل
- رسم نمودار تغییر غلظت نسبت به زمان برای یک واکنش تعادلی
- بررسی اثر تغییر فشار (تغییر حجم) بر یک واکنش تعادلی گازی
- بررسی اثر تغییر فشار (تغییر حجم) بر یک واکنش تعادلی که شامل واکنش دهنده جامد است.

زهره قندهاری
۱۶ آذر ۱۴۰۳علی کرمی
به شبیهساز واکنش های شیمیایی مراجعه کنید:
https://byazma.ir/page/68
در این شبیهساز میتوانید برخی از واکنش های روزمره را مشاهده کنید.